名校
1 . 列实验方案设计、现象和结论都正确的是
| 目的 | 实验方案设计 | 现象和结论 | |
| A | 探究压强对平衡的影响 | 在针筒中充入一定量的NO2气体,压缩针筒,从针简顶部观察到气体颜色变浅 | 压强增大,平衡向气体体积减小的方向移动 |
| B | 探究浓度对平衡移动的影响 | 向K2Cr2O7溶液中缓慢滴加浓盐酸,黄色变为橙色 | 增大c(H+),平衡向生成 的方向移动 的方向移动 |
| C | 检验某溶液中是否含有Fe2+离子 | 向该溶液中滴加几滴新制氯水, 振荡,再加入少量KSCN溶液 | 溶液变为血红色,则该溶液中含有Fe2+离子 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-04-06更新
|
161次组卷
|
3卷引用:江西省宜丰中学创新部2023-2024学年高一上学期10月月考化学试题
江西省宜丰中学创新部2023-2024学年高一上学期10月月考化学试题(已下线)【2023】【高二上】【源清中学】【期末考】【高中化学】【廖汨平收集】吉林省长春外国语学校2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)和软锰矿(主要成分为MnO2)为原料制备超细氧化铋的工艺流程如图:
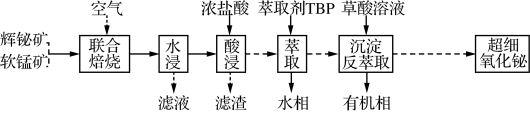
已知:Bi3+易与Cl-形成BiCl ,BiCl
,BiCl 易发生水解,其反应的离子方程式为BiCl
易发生水解,其反应的离子方程式为BiCl +H2O
+H2O BiOCl↓+5Cl-+2H+。
BiOCl↓+5Cl-+2H+。
(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为_____ 。
(2)“酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是______ 。
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、加快搅拌速度外,还可采取的措施有_____ 。
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl (水层)+2TBP(有机层)
(水层)+2TBP(有机层) BiCl3•2TBP(有机层)+3Cl-(水层)。
BiCl3•2TBP(有机层)+3Cl-(水层)。
①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图1所示。c(Cl-)最佳为1.0mol•L-1的可能原因是______ 。

②萃取后分液所得水相中的主要阳离子为_____ (填化学式)。
(4)“沉淀反萃取”时生成草酸铋[Bi2(C2O4)3•7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取”后有机相与草酸溶液的混合方式为_____ 。
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3•7H2O的质量的比值随温度变化的关系如图2所示。400℃时制得超细氧化铋,其化学式为_____ 。(写出计算过程,M[Bi2(C2O4)3•7H2O]=808g•mol-1)


已知:Bi3+易与Cl-形成BiCl
 ,BiCl
,BiCl 易发生水解,其反应的离子方程式为BiCl
易发生水解,其反应的离子方程式为BiCl +H2O
+H2O BiOCl↓+5Cl-+2H+。
BiOCl↓+5Cl-+2H+。(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为
(2)“酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、加快搅拌速度外,还可采取的措施有
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl
 (水层)+2TBP(有机层)
(水层)+2TBP(有机层) BiCl3•2TBP(有机层)+3Cl-(水层)。
BiCl3•2TBP(有机层)+3Cl-(水层)。①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图1所示。c(Cl-)最佳为1.0mol•L-1的可能原因是

②萃取后分液所得水相中的主要阳离子为
(4)“沉淀反萃取”时生成草酸铋[Bi2(C2O4)3•7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取”后有机相与草酸溶液的混合方式为
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3•7H2O的质量的比值随温度变化的关系如图2所示。400℃时制得超细氧化铋,其化学式为

您最近半年使用:0次
2023-03-14更新
|
581次组卷
|
3卷引用:江西省吉安市第三中学2023届高三一模考试化学试题
解题方法
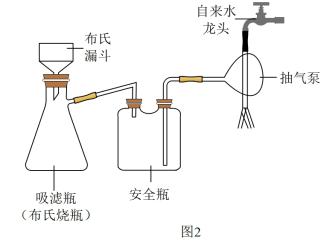
3 . 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成K[CuI2]实验装置如图1所示。

(1)仪器D的名称是________ 。
(2)实验完毕后,用图2所示装置分离CuI的突出优点是_______ 。
(3)某同学向装置C的烧杯中倾倒NaOH溶液时,不慎将少量溶液溅到皮肤上,处理的方法是:_______ 。
(4)装置B中发生反应的离子方程式是_______ 。
(5)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是_______ 。
②根据实验II,CuI与NaOH溶液反应的化学方程式是_______ 。
(6)测定CuI样品纯度。取a g CuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用b mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积为V mL(已知:滴定反应为I2+2 =
= (无色)+2I-)。该样品纯度为
(无色)+2I-)。该样品纯度为_______ (用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准液的滴定管用蒸馏水洗净后没有用标准液润洗,测得结果_______ (填“偏高”“偏低”或“无影响”)。

(1)仪器D的名称是
(2)实验完毕后,用图2所示装置分离CuI的突出优点是

(3)某同学向装置C的烧杯中倾倒NaOH溶液时,不慎将少量溶液溅到皮肤上,处理的方法是:
(4)装置B中发生反应的离子方程式是
(5)小组同学设计下表方案对CuI的性质进行探究:
| 实验 | 实验操作及现象 |
| Ⅰ | 取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀 |
| Ⅱ | 取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液 |
②根据实验II,CuI与NaOH溶液反应的化学方程式是
(6)测定CuI样品纯度。取a g CuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用b mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积为V mL(已知:滴定反应为I2+2
 =
= (无色)+2I-)。该样品纯度为
(无色)+2I-)。该样品纯度为
您最近半年使用:0次
名校
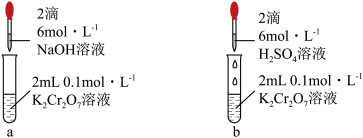
4 . 分析如下实验操作,对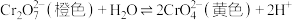 平衡的影响说法正确的是
平衡的影响说法正确的是
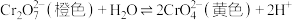 平衡的影响说法正确的是
平衡的影响说法正确的是
| A.元素Cr的价电子数目为1 |
| B.该实验反应属于氧化还原反应 |
| C.试管a中溶液橙色变浅至黄色,说明平衡向正向移动 |
D.试管b中增大 ,平衡向逆向移动,平衡常数减小 ,平衡向逆向移动,平衡常数减小 |
您最近半年使用:0次
2023-02-21更新
|
385次组卷
|
5卷引用:江西省抚州市崇仁一中、广昌一中、金溪县第一中学2022-2023学年高二下学期第一次月考联考化学试题
江西省抚州市崇仁一中、广昌一中、金溪县第一中学2022-2023学年高二下学期第一次月考联考化学试题天津市河西区2023届高三上学期期末质量调查化学试题广东省佛山市南海区狮山石门高级中学2022-2023学年高二下学期3月月考化学试题辽宁省朝阳市部分学校2022-2023学年高二下学期期末考试化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
名校
5 . 向甲、乙两个体积均为2L的恒容密闭容器中分别充入20mol的M,发生反应:
 ,维持容器的温度分别为
,维持容器的温度分别为 ℃和
℃和 ℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
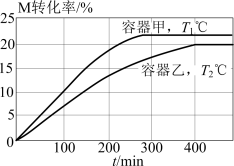

 ,维持容器的温度分别为
,维持容器的温度分别为 ℃和
℃和 ℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
A.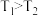 |
| B.维持温度不变,向平衡后的甲容器中充入一定量的M,平衡不移动 |
C. ℃时,反应的平衡常数: ℃时,反应的平衡常数: |
D.  ℃时,向平衡后的乙容器再充入16mol M和2mol N,反应正向进行 ℃时,向平衡后的乙容器再充入16mol M和2mol N,反应正向进行 |
您最近半年使用:0次
2023-02-08更新
|
195次组卷
|
3卷引用:江西省宜春市宜丰中学2022-2023学年高三下学期3月月考化学试题
6 . 由下列实验事实所得出的结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂不参与化学反应 |
| B | 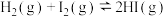 ,压缩容器体积,气体颜色变深 ,压缩容器体积,气体颜色变深 | 增大压强,平衡向逆反应方向移动 |
| C | 将 样品溶于稀盐酸后,滴加KSCN溶液,溶液变红 样品溶于稀盐酸后,滴加KSCN溶液,溶液变红 |  样品变质 样品变质 |
| D | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,溶液颜色变浅 溶液,溶液颜色变浅 |  溶液中存在水解平衡 溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7 . 一定温度下,反应
 ,达到平衡时,下列说法错误的是
,达到平衡时,下列说法错误的是

 ,达到平衡时,下列说法错误的是
,达到平衡时,下列说法错误的是A.将容器体积压缩为原来一半,当体系再次达到平衡时, 的浓度增大 的浓度增大 |
B.继续加入 ,平衡不移动 ,平衡不移动 |
| C.减小氯气浓度,平衡正向移动,平衡常数不变 |
| D.升高温度该反应的化学平衡常数K增大 |
您最近半年使用:0次
名校
8 . 下列叙述与图对应的是
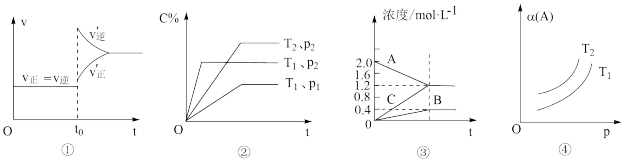

A.已达平衡状态的反应:N2(g)+3H2(g)  2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动 |
B.由图②可知,P2>P1、T1>T2满足反应:2A(g)+B(g)  2C(g) ΔH<0 2C(g) ΔH<0 |
| C.图③表示的反应方程式为:2A(g)=B(g)+3C(g) |
D.由图④可知,对于反应aA(g) bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 bB(g)+cC(g),该反应用于工业生产时,采用的压强越大越好 |
您最近半年使用:0次
2023-02-02更新
|
396次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
9 . 用下列装置不能达到实验目的的是
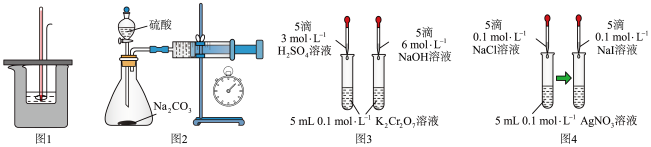

| A.图1:测量强酸强碱中和反应的反应热 |
B.图2:测定 和稀硫酸反应的速率 和稀硫酸反应的速率 |
| C.图3:验证浓度对化学平衡的影响 |
D.图4:证明 |
您最近半年使用:0次
2023-01-14更新
|
353次组卷
|
3卷引用:江西省丰城市第九中学2022-2023学年高一下学期期末考试化学试题
名校
10 . 小组同学探究盐溶液对反应 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ. (黄色)
(黄色)
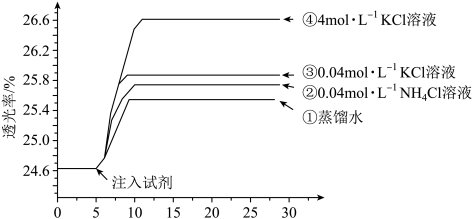
下列说法不正确的是
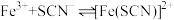 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ.
 (黄色)
(黄色)
下列说法不正确的是
A.注入试剂①后溶液透光率增大,一定是由于 平衡逆向移动引起的 平衡逆向移动引起的 |
| B.透光率③比②高,可能是阳离子种类或溶液pH导致的 |
C.透光率④比③高,可能发生了反应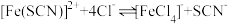 |
D.若要证明试剂③中Cl—对平衡体系有影响,还应使用与试剂③等体积的0.04mol/L的KNO3溶液进行对比实验(已知NO 对实验无影响) 对实验无影响) |
您最近半年使用:0次
2023-01-13更新
|
636次组卷
|
9卷引用:江西省景德镇一中2021-2022学年高二下学期重点班期末考试化学试题



