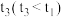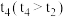1 . 能使反应 的反应速率增大,且平衡向正反应方向移动的是
的反应速率增大,且平衡向正反应方向移动的是
 的反应速率增大,且平衡向正反应方向移动的是
的反应速率增大,且平衡向正反应方向移动的是A.及时分离出 气体 气体 | B.增大 的浓度 的浓度 |
| C.适当降低温度 | D.选择高效催化剂 |
您最近一年使用:0次
名校
解题方法
2 . 实验小组探究外界因素对 平衡的影响。
平衡的影响。
Ⅰ.探究 对该平衡的影响。
对该平衡的影响。
将1 mL 0.005 mol⋅L
 溶液(接近无色)和1 mL 0.01 mol⋅L
溶液(接近无色)和1 mL 0.01 mol⋅L KSCN溶液混合,得到红色溶液。(
KSCN溶液混合,得到红色溶液。( 在溶液中存在平衡:
在溶液中存在平衡: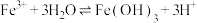 )
)
(1)甲同学认为加入酸后,会使体系中___________ 浓度增大,导致平衡 正向移动,溶液颜色加深。
正向移动,溶液颜色加深。
【设计并实施实验】用上述试剂制备两等份红色溶液,进行如下操作并记录现象。

【查阅资料】 与
与 、
、 均能以下反应:
均能以下反应:
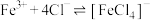 (黄色);
(黄色); (无色)
(无色)
【实验1】探究现象a中溶液颜色变化的原因(实验①②均重新制备红色溶液)
(2)实验①的目的是___________ 。
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:___________ 。
【实验2】探究现象b中溶液呈浅黄色的原因
乙同学认为,原溶液中存在 和
和 ,现象b中使溶液呈浅黄色的微粒可能是
,现象b中使溶液呈浅黄色的微粒可能是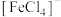 或
或 。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是
。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是 。
。
(4)请将实验③、④的操作补充完整: A.___________ ;B.___________ 。
Ⅱ.探究加水稀释对该平衡的影响。
(5)该小组按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。

___________ ,
___________ 。理论预测,加水稀释,该平衡向___________ (填“正反应”或“逆反应”)方向移动。 和
和 的关系是
的关系是___________ (用含 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
 平衡的影响。
平衡的影响。Ⅰ.探究
 对该平衡的影响。
对该平衡的影响。将1 mL 0.005 mol⋅L

 溶液(接近无色)和1 mL 0.01 mol⋅L
溶液(接近无色)和1 mL 0.01 mol⋅L KSCN溶液混合,得到红色溶液。(
KSCN溶液混合,得到红色溶液。( 在溶液中存在平衡:
在溶液中存在平衡: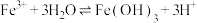 )
)(1)甲同学认为加入酸后,会使体系中
 正向移动,溶液颜色加深。
正向移动,溶液颜色加深。【设计并实施实验】用上述试剂制备两等份红色溶液,进行如下操作并记录现象。

【查阅资料】
 与
与 、
、 均能以下反应:
均能以下反应: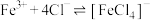 (黄色);
(黄色); (无色)
(无色)【实验1】探究现象a中溶液颜色变化的原因(实验①②均重新制备红色溶液)
| 编号 | 操作 | 现象 |
| ① | 向2 mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2 mL红色溶液中滴加5滴3 mol·L KCl溶液 KCl溶液 | 溶液颜色变浅,呈橙色 |
(2)实验①的目的是
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a:
【实验2】探究现象b中溶液呈浅黄色的原因
乙同学认为,原溶液中存在
 和
和 ,现象b中使溶液呈浅黄色的微粒可能是
,现象b中使溶液呈浅黄色的微粒可能是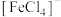 或
或 。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是
。乙同学通过下列实验,证实了现象b中使溶液呈浅黄色的微粒只是 。
。| 编号 | 操作 | 现象 |
| ③ | 取1 mL 0.0025 mol·L A溶液,加入1 mL 0.01 mol·L A溶液,加入1 mL 0.01 mol·L KSCN溶液,再加入5滴1.5 mol·L KSCN溶液,再加入5滴1.5 mol·L  溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1 mL 0.005 mol·L  溶液,加入B,再加入5滴1.5 mol·L 溶液,加入B,再加入5滴1.5 mol·L  溶液 溶液 | 无明显现象 |
(4)请将实验③、④的操作补充完整: A.
Ⅱ.探究加水稀释对该平衡的影响。
(5)该小组按下表配制总体积相同的系列溶液,测定平衡时
 浓度,记录数据。
浓度,记录数据。| 编号 | 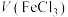 /mL /mL | V(KSCN)/mL |  /mL /mL |  /mol·L /mol·L |
| ⑤ | 10 | 10 | 0 |  |
| ⑥ | 2 | a | b |  |


 和
和 的关系是
的关系是 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
您最近一年使用:0次
名校
解题方法
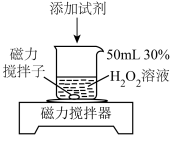
3 . 过氧化氢是一种常用的绿色试剂,某学习小组针对 性质进行如图实验。
性质进行如图实验。
Ⅰ.验证 的还原性
的还原性
查阅资料: 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。
(1)制取氯水
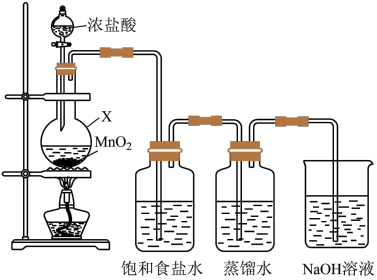
① 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是________ (用平衡移动原理解释)。
②取5mL上述新制饱和氯水于试管中,向其中加入 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是________ 。
Ⅱ.探究 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
(2)实验结果显示 ,可得出的结论是:
,可得出的结论是:________ (填化学式)更有利于 分解。
分解。
(3)甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为________  的
的________ (填化学式)溶液和________ (填化学式)溶液。 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。
(4)乙同学又提出猜想: 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
A. 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C.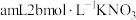 溶液,D.少量
溶液,D.少量 固体
固体
(5)根据实验1~4中测得的 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
________ (填“增强”或“减弱”,下同) 的催化效果,
的催化效果,
________  的催化效果。
的催化效果。
 性质进行如图实验。
性质进行如图实验。Ⅰ.验证
 的还原性
的还原性查阅资料:
 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。(1)制取氯水

①
 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是②取5mL上述新制饱和氯水于试管中,向其中加入
 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是Ⅱ.探究
 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
| 实验序号 | 添加试剂及用量 |
|
1 |
|
| |
2 |
|
|
(2)实验结果显示
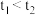 ,可得出的结论是:
,可得出的结论是: 分解。
分解。(3)甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为 的
的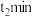 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。(4)乙同学又提出猜想:
 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:A.
 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C.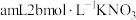 溶液,D.少量
溶液,D.少量 固体
固体
| 实验序号 | 添加试剂 |
|
3 | 需同时加入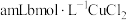 溶液和① 溶液和① |
| |
4 | 需同时加入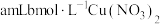 溶液和② 溶液和② |
|
(5)根据实验1~4中测得的
 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
 的催化效果,
的催化效果,
 的催化效果。
的催化效果。
您最近一年使用:0次
4 . 下列叙述中,不能用勒夏特列原理解释的是
A.合成氨工业的反应: ,增大压强有利于氨的合成 ,增大压强有利于氨的合成 |
| B.向双氧水中加入二氧化锰有利于氧气生成 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| D.用饱和食盐水吸收氯气中的HCl |
您最近一年使用:0次
名校
5 . 某同学利用如图所示装置探究勒夏特列原理,请根据所学知识回答下列问题:

已知:①在2号瓶中插入可上下抽拉的铜丝和加入浓硝酸(图中均未画出)。实验开始时,将铜丝插入浓硝酸中,当1号、2号、3号瓶内充满气体且气体颜色一致时,将铜丝抽离硝酸,关闭 K1、K2、K3、K4。
②2NO2=N2O4 ΔH<0。
(1)在实验开始前需进行的操作为___________ ;装置A、B的作用为___________ 。
(2)请写出铜丝与浓硝酸反应的化学方程式:___________ 。
(3)探究温度对化学平衡的影响:把1号瓶置于热水中,把3号瓶置于冰水中,把2号瓶置于室温下,一段时间后观察对比1、2、3号瓶中气体颜色的变化。
①把2号瓶置于室温下的目的是___________ 。
②1号瓶中的现象为___________ ,其中气体的平均摩尔质量较温度变化前___________ (填“增大”、“减小”或“不变”)。
③3号瓶中的现象为___________ 。
(4)探究压强对化学平衡的影响:
将注射器插入2号瓶,往上拉注射器活塞到5mL刻度处,待___________ 时,取出注射器,将针头处密封,将注射器活塞迅速拉到 20mL刻度处,观察到注射器内气体颜色先变浅随后又逐渐变深,但最终比2号瓶内气体颜色浅。解释气体颜色发生如此变化的原因:___________ 。

已知:①在2号瓶中插入可上下抽拉的铜丝和加入浓硝酸(图中均未画出)。实验开始时,将铜丝插入浓硝酸中,当1号、2号、3号瓶内充满气体且气体颜色一致时,将铜丝抽离硝酸,关闭 K1、K2、K3、K4。
②2NO2=N2O4 ΔH<0。
(1)在实验开始前需进行的操作为
(2)请写出铜丝与浓硝酸反应的化学方程式:
(3)探究温度对化学平衡的影响:把1号瓶置于热水中,把3号瓶置于冰水中,把2号瓶置于室温下,一段时间后观察对比1、2、3号瓶中气体颜色的变化。
①把2号瓶置于室温下的目的是
②1号瓶中的现象为
③3号瓶中的现象为
(4)探究压强对化学平衡的影响:
将注射器插入2号瓶,往上拉注射器活塞到5mL刻度处,待
您最近一年使用:0次
名校
6 . 由下列实验事实所得出的结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 某温度下,向容积可变的密闭容器中加入足量CaCO3,发生反应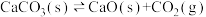 ,并达到平衡,将容器容积增大为原来的2倍 ,并达到平衡,将容器容积增大为原来的2倍 | 当体系再次达到平衡时,气体密度不变 |
| B | 恒温恒容条件下, ,增加 ,增加 的物质的量 的物质的量 | H2O的平衡转化率提高,且增大其反应速率 |
| C | 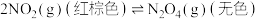  ,在反应达到平衡后,对平衡体系采取缩小容积、增大压强的措施, ,在反应达到平衡后,对平衡体系采取缩小容积、增大压强的措施, | 因为平衡向正反应方向移动,故体系颜色变浅 |
| D | 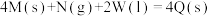 常温下,自发进行 常温下,自发进行 | 则ΔH>0 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 已知
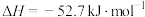 ,常温下N2O4为无色气体。
,常温下N2O4为无色气体。
(1)某课外活动小组为了探究压强对化学平衡的影响,设计了相关实验,请根据所学知识预测实验结果:在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色___________ (填“变深”、“变浅”或“不变”),一段时间后气体颜色___________ (填“变深”、“变浅”或“不变”),但仍比拉动活塞之前针筒内气体的颜色___________ (填“深”或“浅”)。在此过程中,该反应的化学平衡常数___________ (填“增大”、“减小”或“不变”),混合气体中NO2的百分含量___________ (填“增大”、“减小”或“不变”)。
(2)利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是___________ 。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为___________ 。
③图像中C、E两点气体平均摩尔质量较大的点为___________ (填代号)。
(3)某温度下,在体积恒为1 L的密闭容器内,起始时只加入1 mol NO2,达到平衡时其转化率为75%,则该温度下反应 的平衡常数
的平衡常数
___________ L⋅mol-1。

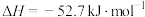 ,常温下N2O4为无色气体。
,常温下N2O4为无色气体。(1)某课外活动小组为了探究压强对化学平衡的影响,设计了相关实验,请根据所学知识预测实验结果:在容积为30cm3针筒中抽入10cm3的NO2气体,将针筒前端封闭,静置一段时间至气体颜色不变。将针筒活塞拉至20cm3处,此时气体的颜色
(2)利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①有关该过程说法正确的是
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②反应至B点时NO2的转化率为
③图像中C、E两点气体平均摩尔质量较大的点为
(3)某温度下,在体积恒为1 L的密闭容器内,起始时只加入1 mol NO2,达到平衡时其转化率为75%,则该温度下反应
 的平衡常数
的平衡常数
您最近一年使用:0次
名校
8 . 下列事实中,不能用勒夏特列原理解释的是
| A.90℃纯水的pH<7 |
| B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 |
| C.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
D.溴水中存在如下平衡: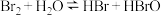 ,当加入NaOH溶液后颜色变浅 ,当加入NaOH溶液后颜色变浅 |
您最近一年使用:0次
名校
解题方法
9 . 炼铁厂用铁矾渣制备FeCO3过程如图:
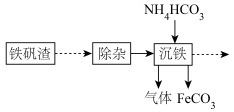
其中沉铁的过程中加入NH4HCO3,实现向目标产物碳酸亚铁的转化,碳酸亚铁可用于制备补血剂。某研究小组模拟“沉铁”过程设计如图实验,在实验室制备FeCO3。
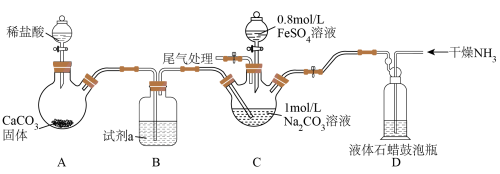
已知:FeCO3是白色固体,难溶于水。
【实验I】
(1)试剂a的作用是________ 。
(2)关闭C、D之间的止水夹,向C装置的Na2CO3溶液中通入足量CO2气体,写出发生反应的离子方程式________ ,再加入0.8mol/LFeSO4溶液后,观察到C装置中产生气泡(CO2)和白色沉淀(主要是FeCO3),请结合化学用语从平衡的角度解释产生气泡和FeCO3的原因________ 。
(3)产生白色沉淀,经过滤、洗涤、干燥,最终得到FeCO3固体,但固体产品检测后发现纯度并不高,则可能含有的杂质是________ (写化学式)。

其中沉铁的过程中加入NH4HCO3,实现向目标产物碳酸亚铁的转化,碳酸亚铁可用于制备补血剂。某研究小组模拟“沉铁”过程设计如图实验,在实验室制备FeCO3。

已知:FeCO3是白色固体,难溶于水。
【实验I】
(1)试剂a的作用是
(2)关闭C、D之间的止水夹,向C装置的Na2CO3溶液中通入足量CO2气体,写出发生反应的离子方程式
(3)产生白色沉淀,经过滤、洗涤、干燥,最终得到FeCO3固体,但固体产品检测后发现纯度并不高,则可能含有的杂质是
您最近一年使用:0次
解题方法
10 . 我国 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ. 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应: ;
; ;
;
Ⅲ.成气合成甲醇: ;
; ;
;
回答下列问题:
①基态 的3d电子轨道表示式为
的3d电子轨道表示式为___________ 。
②
___________  ,
,
___________ (用 ,
, 表示)。
表示)。
(2)若 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: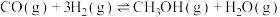 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。
①在 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
___________ ,该条件下的平衡常数K=___________ 。
②下列说法正确的是___________ 。
A.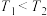
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)
由表格中的数据可知,相同温度下不同的催化剂对 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________ (填字母符号)。
(4)在p=4.00MPa、原料气 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性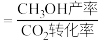 。
。

① 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是___________ 。
② 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是___________ 。
 加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。
加氢制甲醇技术取得了大突破,对解决能源紧缺和环境问题具有重要意义。(1)铜基催化剂制甲醇其主要反应如下:
Ⅰ.
 合成甲醇:
合成甲醇: ;
; ;
;
Ⅱ.逆水煤气反应:
 ;
; ;
;
Ⅲ.成气合成甲醇:
 ;
; ;
;
回答下列问题:
①基态
 的3d电子轨道表示式为
的3d电子轨道表示式为②

 ,
,
 ,
, 表示)。
表示)。(2)若
 时将6mol
时将6mol  和8mol
和8mol  充入容积为2L的密闭容器中只发生反应Ⅰ:
充入容积为2L的密闭容器中只发生反应Ⅰ: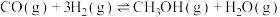 ,
, 的物质的量变化如上表所示。
的物质的量变化如上表所示。| 物质的量/mol |  /℃ /℃ |  /℃ /℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
 ℃条件下5-10min内,以
℃条件下5-10min内,以 表示的该反应速率
表示的该反应速率
②下列说法正确的是
A.
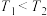
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
(3)某研究小组对催化剂材料进行了研究。下列四组实验,控制
 和
和 初始投料比均为1∶2.2,经过相同反应时间(
初始投料比均为1∶2.2,经过相同反应时间( min)
min)| 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) | 综合选项 |
| 543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
| 543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
| 553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
| 553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
 的转化为
的转化为 的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(4)在p=4.00MPa、原料气
 、合适催化剂的条件下发生反应,温度对
、合适催化剂的条件下发生反应,温度对 转化率、
转化率、 产率、
产率、 选择性的影响如图所示。已知:
选择性的影响如图所示。已知: 的选择性
的选择性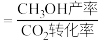 。
。
①
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是②
 选择性随温度升高而减小的原因可能是
选择性随温度升高而减小的原因可能是
您最近一年使用:0次

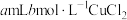 溶液
溶液
 溶液
溶液