解题方法
1 . 自发进行的化学反应大多数是_____ 反应,也有些是_____ 反应。(填“吸热”或“放热”)
您最近一年使用:0次
解题方法
2 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以 为催化剂,可使
为催化剂,可使 在温和条件下转化为甲醇,反应历程如图所示。
在温和条件下转化为甲醇,反应历程如图所示。 与
与 在活化后的催化剂表面发生可逆反应,每生成1mol
在活化后的催化剂表面发生可逆反应,每生成1mol 放热49.3kJ。
放热49.3kJ。
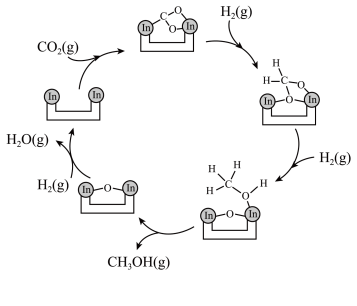
下列说法错误的是
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以 为催化剂,可使
为催化剂,可使 在温和条件下转化为甲醇,反应历程如图所示。
在温和条件下转化为甲醇,反应历程如图所示。 与
与 在活化后的催化剂表面发生可逆反应,每生成1mol
在活化后的催化剂表面发生可逆反应,每生成1mol 放热49.3kJ。
放热49.3kJ。
下列说法错误的是
A.该反应的 |
B.该反应的平衡常数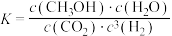 |
C.向容器中充入1mol 和足量 和足量 后,在催化剂存在下充分反应放热49.3kJ 后,在催化剂存在下充分反应放热49.3kJ |
D.该反应中每消耗1molCO2转移电子数为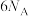 |
您最近一年使用:0次
2024-03-07更新
|
77次组卷
|
2卷引用:河南省焦作市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
3 . 下列叙述正确的是
A. 的燃烧热为 的燃烧热为 ,则 ,则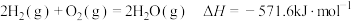 |
B. ,则 ,则 和 和 充分反应放热 充分反应放热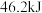 |
C.反应 的 的 且 且 ,该反应在较低温度下可自发反应 ,该反应在较低温度下可自发反应 |
D.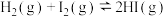 ,改变条件使 ,改变条件使 浓度增大时,平衡一定发生移动 浓度增大时,平衡一定发生移动 |
您最近一年使用:0次
2024-02-27更新
|
78次组卷
|
2卷引用:河南省沁阳一中2023—2024学年高二下学期开学考试 化学试卷
解题方法
4 . 下列说法中,正确的是
| A.自发进行的反应一定不是吸热反应 |
| B.冰在室温下自动熔化成水,这是熵增的过程 |
| C.化学反应热只是由反应过程中化学键的断裂和生成来决定的 |
| D.孤立体系中进行的化学反应,反应混合物温度一定会发生明显变化 |
您最近一年使用:0次
名校
5 . 合成氨反应为:N2(g)+3H2(g)  2NH3(g) ΔH= -92.4kJ·mol-1,下列说法正确的是
2NH3(g) ΔH= -92.4kJ·mol-1,下列说法正确的是
 2NH3(g) ΔH= -92.4kJ·mol-1,下列说法正确的是
2NH3(g) ΔH= -92.4kJ·mol-1,下列说法正确的是| A.合成氨反应在任何温度下都能自发 | B.将混合气体进行循环利用符合绿色化学思想 |
| C.合成氨实际生产中选择高压和低温 | D.将氨液化分离,可促进平衡正移,加快反应速率 |
您最近一年使用:0次
名校
6 . 反应SiCl4(g)+2H2(g)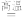 Si(s)+4HCl(g)用于纯硅的制备。下列有关该反应的说法不正确的是
Si(s)+4HCl(g)用于纯硅的制备。下列有关该反应的说法不正确的是
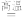 Si(s)+4HCl(g)用于纯硅的制备。下列有关该反应的说法不正确的是
Si(s)+4HCl(g)用于纯硅的制备。下列有关该反应的说法不正确的是| A.该反应ΔH>0,ΔS>0 |
| B.高温下反应每生成1molSi需消耗2×22.4LH2 |
C.该反应的逆反应平衡常数K=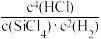 |
| D.用E表示键能,该反应ΔH═4E(Si-Cl)+2E(H-H)-4E(H-Cl)-2E(Si-Si) |
您最近一年使用:0次
名校
解题方法
7 . 甲醇(CH3OH)是重要有机化工原料,现在全球的能源紧张,甲醇需求也在增大。利用合成气(主要成分为CO和H2)在催化剂的作用下合成甲醇的方法是:CO(g)+2H2(g) CH3OH(g) ∆H。
CH3OH(g) ∆H。
(1)已知该反应为自发反应,则∆H___________ 0。(填“>”,“<”或“=”)
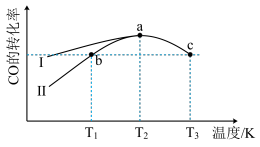
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。
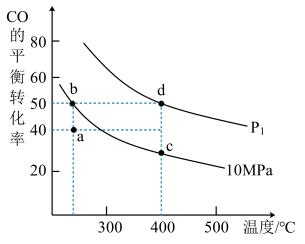
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①P1___________ 10Mpa(填“>”或“<”);
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为___________ 。
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有___________ 。(至少写出两方面的原因)
④在10Mpa下,求a点的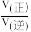 =
=___________ 。(保留1位小数)
 CH3OH(g) ∆H。
CH3OH(g) ∆H。(1)已知该反应为自发反应,则∆H
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。

| A.使用催化剂Ⅰ时,反应的活化能较高 |
| B.b点时v正>v逆。 |
| C.KT1对应的平衡常数等于KT3对应的平衡常数 |
| D.在相同时间t内,理论上最佳生产温度应为T2 |
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。

①P1
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有
④在10Mpa下,求a点的
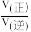 =
=
您最近一年使用:0次
名校
8 . 按要求回答下列问题。
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___________ ,判断该反应自发进行的条件:___________ 。(填“高温自发”或“低温自发”)
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是___________
a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是___________ (填编号)属于弱电解质的是___________ (填编号)
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是___________ (填“逐渐变强”、“逐渐变弱”、“先变强后变弱”、“先变弱后变强”和“几乎不变”)
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应N2(g)+O2(g)⇌2NO(g)是导致汽车尾气中含有NO的原因之一、已知H2可以催化还原NO达到消除污染的目的。
N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ∙mol-1
2H2(g)+O2(g)⇌2H2O(l) △H=-571.6kJ∙mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
(2)已知H2S为二元弱酸,欲使0.1mol•L-1的H2S溶液中
 的比值变大,下列措施可行的是
的比值变大,下列措施可行的是a.加入H2O b.通入少量H2S c.通入少量HCl d.加入少量NaOH固体
(3)有下列物质:①Zn②KAl(SO4)2∙12H2O③Ba(OH)2④乙醇⑤冰醋酸⑥盐酸⑦Cu(NO3)2溶液⑧熔融态AlCl3⑨NH3∙H2O⑩熔融态CH3COONa⑪NaHCO3。其中属于能导电的电解质的是
(4)若向0.1mol∙L-1的弱碱MOH溶液中逐滴加入0.1mol∙L-1的弱酸HB至恰好反应,溶液的导电性变化规律是
您最近一年使用:0次
名校
解题方法
9 . 下列叙述中,正确的是
A.甲烷的标准燃烧热为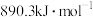 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为: |
B.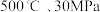 下,将 下,将 和 和 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成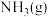 ,放热 ,放热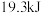 ,其热化学方程式为: ,其热化学方程式为: |
C.相同条件下, 氢原子所具有的能量小于 氢原子所具有的能量小于 氢分子所具有的能量 氢分子所具有的能量 |
D.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
您最近一年使用:0次
名校
解题方法
10 . 汽车尾气处理系统的催化转化器中发生的主要反应为: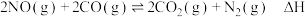 。回答下列与该反应有关的问题。
。回答下列与该反应有关的问题。
(1)在恒温恒容的密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是____________(填字母序号)。
(2)向甲、乙两个恒温、恒容(体积均为2L)的密闭容器内分别加入相同物质的量的NO和CO,在不同时刻测得两容器内NO的物质的量随时间的变化情况如下表:
①甲容器中0~120min内,用 表示的平均反应速率
表示的平均反应速率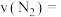
______  。
。
②
____  ,该反应的
,该反应的
______ 0。(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③该反应能够自发进行的条件是______ (填“低温”“高温”或“任何温度”)。
④ 时,该反应的平衡常数
时,该反应的平衡常数
_______ 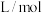 。
。
(3)T℃时,在密闭容器内充入一定量的NO和CO,发生上述反应,测得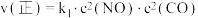 、
、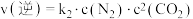 (
( 、
、 为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。

①压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是_______ ,理由是_______________________ 。
②该反应的平衡常数
_____________ (用 、
、 表示)。
表示)。
③达到平衡后,压缩容器体积,在达到新的平衡之前,
______ 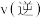 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
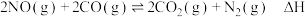 。回答下列与该反应有关的问题。
。回答下列与该反应有关的问题。(1)在恒温恒容的密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是____________(填字母序号)。
| A.容器内气体的密度不再改变 | B.容器内气体的平均摩尔质量不再改变 |
| C.容器内气体的压强不再改变 | D.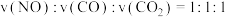 |
| 时间/min | 0 | 40 | 80 | 120 | 160 | |
甲容器恒温为 |  | 4.00 | 3.00 | 2.20 | 1.60 | 1.60 |
乙容器恒温为 |  | 4.00 | 2.90 | 2.00 | 2.00 | 2.00 |
 表示的平均反应速率
表示的平均反应速率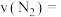
 。
。②

 ,该反应的
,该反应的
 ”、“
”、“ ”或“
”或“ ”)。
”)。③该反应能够自发进行的条件是
④
 时,该反应的平衡常数
时,该反应的平衡常数
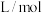 。
。(3)T℃时,在密闭容器内充入一定量的NO和CO,发生上述反应,测得
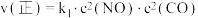 、
、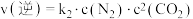 (
( 、
、 为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
①压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②该反应的平衡常数

 、
、 表示)。
表示)。③达到平衡后,压缩容器体积,在达到新的平衡之前,

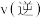 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次



