1 . 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:
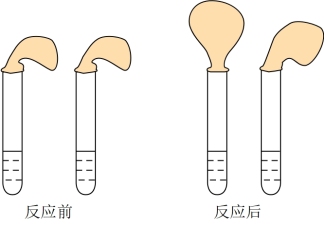
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH____ 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:____ 。
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第____ 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂(选填“A”“B’“C”“D”下同)。
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入____ 试剂。
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA

甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入0.1 mol∙L−1的HA、HCl溶液各10mL,按图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol∙L−1HA和HCl溶液的pH;
②再取0.1 mol∙L−1的HA和HCl溶液各2滴(1滴约为
 mL)分别稀释至100mL,再用pH计测其pH变化。
mL)分别稀释至100mL,再用pH计测其pH变化。(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol∙L−1的HA溶pH
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol∙L−1的HA溶液中,选择加入
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol∙L−1的HA溶液中,选择加入
A.NaA固体(可完全溶于水) B.1 mol∙L−1NaOH溶液
C.1 mol∙L−1H2SO4 D.2 mol∙L−1HA
您最近一年使用:0次
2022-09-25更新
|
265次组卷
|
2卷引用:微专题(6) 一元强酸与一元弱酸的比较
名校
2 . 25℃时,以0.10 mol∙L−1盐酸滴定0.10 mol∙L−1一元碱YOH的滴定曲线如图所示,下列表述错误的是
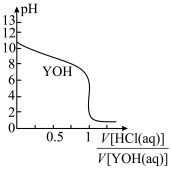

| A.YOH的电离方程式为YOH=Y++OH- | B.此实验可选用甲基橙作指示剂 |
| C.YOH的电离平衡常数Kb≈1×10−5 | D.滴定时盐酸盛放在带活塞的滴定管中 |
您最近一年使用:0次
2022-09-25更新
|
373次组卷
|
3卷引用:实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)河南省豫北名校2022-2023学年高二上学期9月教学质量检测化学试题河南省汝州市第一高级中学2022-2023学年高二上学期11月月考化学试题
3 . 已知H2A为二元弱酸,25℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随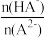 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

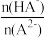 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是
| A.NaHA溶液中:c(H+)>c(OH-) | B.Na2A溶液中:c(A2-)>c(HA-) |
| C.H2A的第二步电离常数为10-7.2 | D.当吸收液呈中性时:c(Na+)=c(A2-)+c(HA-) |
您最近一年使用:0次
2022-09-22更新
|
515次组卷
|
8卷引用:鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系
鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系选择性必修1(SJ)专题3第三单元课时3 溶液中粒子浓度的大小关系3.3.3盐类水解的应用 课后微专题(9) 利用图像判断溶液粒子浓度关系湖南H11教育联盟2018年1月高三联考化学试题山东省济南黄河双语实验学校2021-2022学年高二上学期期中考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
解题方法
4 . 下列实验事实不能证明醋酸是弱电解质的是
| A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 |
| B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱 |
您最近一年使用:0次
2022-09-22更新
|
809次组卷
|
25卷引用:鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末总结
鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末总结鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡(已下线)3.2.1 溶液的酸碱性-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省浠水县实验高级中学2018-2019学年高二上学期12月月考化学试题.江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题贵州省北京师范大学遵义附属学校2019-2020学年高二下学期第二次月考化学试题浙江省天台中学2021-2022学年高二上学期返校考试化学试题(已下线)必考点06 水的电离和溶液pH-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)浙江省“七彩阳光”新高考研究联盟2021-2022学年高二上学期期中联考化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题吉林省延吉市第一高级中学2021-2022年学年高二上学期期中考试化学试题吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题河南省洛阳市新安县第一高级中学2021-2022学年高二上学期10月月考化学试题河南省潢川第一中学2022-2023学年高二上学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二上学期期末考试化学试题湖南省株洲市渌口区第三中学2022-2023学年高二下学期期中考试化学试题辽宁省大连市第八中学2022-2023学年高二上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题河北定州中学2023-2024学年高二上学期12月月考化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题江苏省徐州市第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 用 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是

 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
A.X曲线代表草酸,Y曲线代表醋酸, |
B.醋酸溶液在滴定过程中始终有 |
C.若b点时 ,则b点溶液中 ,则b点溶液中 |
D.若a点 ,则a点有 ,则a点有 |
您最近一年使用:0次
2022-09-06更新
|
694次组卷
|
6卷引用:微专题(9) 利用图像判断溶液粒子浓度关系
6 . 下列属于水解反应的离子方程式且书写正确的是
A.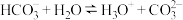 |
B.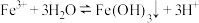 |
C.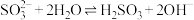 |
D. |
您最近一年使用:0次
7 . 科学家们通过精确的导电性实验证明,纯水中除了大量的水分子,还存在极少量的 和
和 。根据这个信息推断,下列叙述错误的是
。根据这个信息推断,下列叙述错误的是
 和
和 。根据这个信息推断,下列叙述错误的是
。根据这个信息推断,下列叙述错误的是A.水中存在极少量的 和 和 ,说明水是一种极弱的电解质 ,说明水是一种极弱的电解质 |
| B.常温下,水的电离需要通电才能进行 |
C.若液氨的电离与水相似,则液氨的电离方程式可以表示为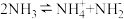 |
| D.“冰,水为之,而寒于水”说明水结冰时会释放能量 |
您最近一年使用:0次
8 .  时,有
时,有 的一组醋酸、醋酸钠的混合溶液,溶液中
的一组醋酸、醋酸钠的混合溶液,溶液中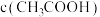 、
、 与
与 的关系如图所示。下列有关溶液中粒子浓度关系的叙述正确的是
的关系如图所示。下列有关溶液中粒子浓度关系的叙述正确的是

 时,有
时,有 的一组醋酸、醋酸钠的混合溶液,溶液中
的一组醋酸、醋酸钠的混合溶液,溶液中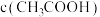 、
、 与
与 的关系如图所示。下列有关溶液中粒子浓度关系的叙述正确的是
的关系如图所示。下列有关溶液中粒子浓度关系的叙述正确的是
A. 的溶液中: 的溶液中: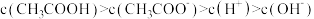 |
B. 点所表示的溶液中: 点所表示的溶液中: |
C. 的溶液中: 的溶液中: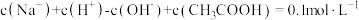 |
D.向 点所表示的 点所表示的 溶液中通入 溶液中通入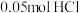 气体(溶液体积变化可忽略): 气体(溶液体积变化可忽略):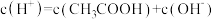 |
您最近一年使用:0次
名校
9 . 表中数据是几种弱酸常温下的电离平衡常数:
下列说法中不正确的是
 |  |  |  |
 | 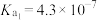 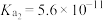 | 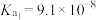  |  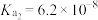 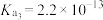 |
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释 溶液, 溶液, 减小 减小 |
D.向弱酸溶液中加少量 溶液,恢复到常温,该弱酸的电离平衡常数不变 溶液,恢复到常温,该弱酸的电离平衡常数不变 |
您最近一年使用:0次
2022-09-04更新
|
979次组卷
|
5卷引用:第一节 电离平衡
第一节 电离平衡新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)天津市南蔡村中学2023-2024学年高二上学期第二次月考化学试卷天津市武清区河西务中学2023-2024学年高二上学期第三次月考化学试题
10 . 在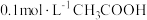 溶液中存在:
溶液中存在: ,对于该平衡,下列叙述错误的是
,对于该平衡,下列叙述错误的是
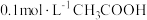 溶液中存在:
溶液中存在: ,对于该平衡,下列叙述错误的是
,对于该平衡,下列叙述错误的是A.加入少量冰醋酸,电离平衡向正向移动, 保持不变 保持不变 |
B.加入少量 固体,溶液中 固体,溶液中 浓度减小 浓度减小 |
C.升高温度,醋酸的电离程度增大,溶液 减小 减小 |
D.加入少量 固体, 固体, 减小 减小 |
您最近一年使用:0次



