名校
1 . H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。下列关于H2S溶液的说法正确的是
H++S2-。下列关于H2S溶液的说法正确的是
 H++HS-和HS-
H++HS-和HS- H++S2-。下列关于H2S溶液的说法正确的是
H++S2-。下列关于H2S溶液的说法正确的是| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
| C.通入过量SO2气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
您最近一年使用:0次
2023-08-14更新
|
939次组卷
|
2卷引用:作业(十二) 弱电解质的电离平衡
名校
解题方法
2 . 25℃时,下列有关电解质溶液的说法正确的是
A.加水稀释0.1mol·L-1氨水,溶液中c(H+)·c(OH-)和 的值保持不变 的值保持不变 |
B.向CH3COONa溶液中加入少量CH3COONa,溶液中 的值减小 的值减小 |
C.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: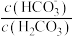 > >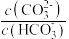 |
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终增大 始终增大 |
您最近一年使用:0次
2023-08-14更新
|
1315次组卷
|
3卷引用:作业(十三) 电离平衡常数
解题方法
3 . 用pH试纸测定溶液的pH,下列叙述正确的是
| A.测得某浓度的NaClO溶液的pH为10 |
| B.常温下测得HCl溶液pH约为4.1 |
| C.用湿润的pH试纸测pH相同的盐酸和醋酸溶液的pH,误差较大的是盐酸 |
| D.在试管内放入少量溶液并煮沸,把pH试纸放在管口观察其颜色并与标准比色卡比较 |
您最近一年使用:0次
2023-08-14更新
|
478次组卷
|
2卷引用:作业(十四) 水的电离 溶液的酸碱性与 pH
4 . 在氨水中,NH3·H2O的电离达到平衡的标志是
| A.溶液呈电中性 | B.溶液中无氨水分子 |
| C.c(OH-)保持不变 | D.溶液中 和OH-共存 和OH-共存 |
您最近一年使用:0次
2023-08-14更新
|
705次组卷
|
5卷引用:第1课时 弱电解质的电离平衡
5 . 某浓度的氨水中存在下列平衡:NH3·H2O
 +OH-,若想增大
+OH-,若想增大 的浓度,而不增大OH-的浓度,应采取的措施是
的浓度,而不增大OH-的浓度,应采取的措施是

 +OH-,若想增大
+OH-,若想增大 的浓度,而不增大OH-的浓度,应采取的措施是
的浓度,而不增大OH-的浓度,应采取的措施是| A.适当升高温度 | B.加入NH4Cl固体 |
| C.通入NH3 | D.加水稀释 |
您最近一年使用:0次
2023-08-14更新
|
354次组卷
|
4卷引用:第1课时 弱电解质的电离平衡
解题方法
6 . 醋酸的电离方程式为CH3COOH(aq) H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: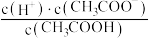 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
 H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系:
H+(aq)+CH3COO-(aq) ΔH>0.25 ℃时,0.1 mol/L醋酸溶液中存在下述关系: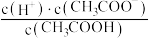 =1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是| A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
| B.向该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01 mol/L的醋酸溶液Ka<1.75×10-5 |
| D.升高温度,c(H+)增大,Ka变大 |
您最近一年使用:0次
7 . 下列关于弱电解质的电离平衡常数的叙述中,正确的是
| A.弱电解质的电离平衡常数就是电解质溶于水后电离出的各种离子浓度的乘积与未电离分子的浓度的比值 |
| B.弱电解质的电离平衡常数只与弱电解质本身的性质及外界温度有关 |
| C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱 |
| D.多元弱酸的各级电离平衡常数相同 |
您最近一年使用:0次
2023-08-14更新
|
515次组卷
|
3卷引用:第2课时 电离平衡常数
名校
8 . 下列说法错误的是
| A.pH相同的NaOH溶液与Ba(OH)2溶液以任意体积比混合,pH不变 |
| B.浓度均为0.1 mol·L-1的NaOH溶液与Ba(OH)2溶液等体积混合,pH不变 |
| C.常温下,pH=2的溶液与pH=12的溶液等体积混合后,混合溶液的pH不一定等于7 |
| D.常温下,0.05 mol·L-1的硫酸与0.05 mol·L-1的氢氧化钠溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
2023-08-14更新
|
866次组卷
|
4卷引用:第2课时 溶液 pH的计算
名校
9 . 下列事实中一定不能证明CH3COOH是弱电解质的是
①等物质的量浓度、等体积的盐酸、CH3COOH溶液和足量锌反应,根据产生氢气的多少
②用CH3COOH溶液做导电实验,灯泡很暗
③等c(H+)、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的c(H+)=1.0×10-2 mol·L-1
⑤CH3COONa和H3PO4反应,生成CH3COOH
①等物质的量浓度、等体积的盐酸、CH3COOH溶液和足量锌反应,根据产生氢气的多少
②用CH3COOH溶液做导电实验,灯泡很暗
③等c(H+)、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的c(H+)=1.0×10-2 mol·L-1
⑤CH3COONa和H3PO4反应,生成CH3COOH
| A.①② | B.②⑤ | C.①③⑤ | D.③④⑤ |
您最近一年使用:0次
2023-08-14更新
|
1210次组卷
|
5卷引用:微专题(6) 一元强酸与一元弱酸的比较
10 . 常温下,将稀盐酸滴加到等浓度的弱碱AOH溶液中,测得混合液的pH和lg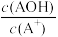 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是

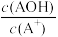 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是
| A.常温下,A+的水解平衡常数为1.0×10-10 |
| B.e点溶液中水电离出的H+浓度为10-6.23 mol·L-1 |
| C.c点溶液中:n(A+)+n(AOH)>n(Cl-) |
| D.d点溶液中:c(Cl-)>c(AOH)>c(A+) |
您最近一年使用:0次



