名校
解题方法
1 . 对氨基苯酚可用作农药、医药、染料等精细化学品的中间体,利用Al-PbO2电池(其装置如图甲所示)作为电源电解硝基苯制备对氨基苯酚,其装置如图乙所示。已知电池工作过程中R区的K2SO4溶液浓度增大,下列说法正确的是
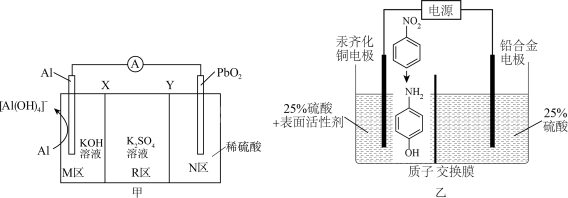
| A.X为阴离子交换膜 |
| B.铅合金电极应与Al电极相连 |
C.汞齐化铜电极上的反应式为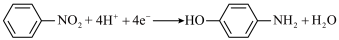 |
D.PbO2电极上的反应式为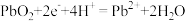 |
您最近一年使用:0次
2024-05-12更新
|
119次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
解题方法
2 . 如下图设计的串联电池装置,R为变阻器,以调节电路电流。
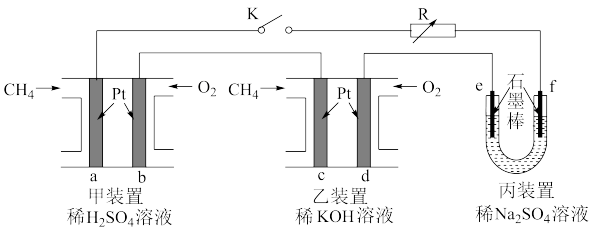
(1)写出b、c电极的电极反应式:b______________ ,c_______________ ;
(2)写出f电极的电极反应式____________________ ,向此电极区域滴入酚酞的现象为:_____________ ;该电极区域水的电离平衡被____________ (填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________ (填“变大”、“变小”或“不变”),原因是______________ 。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______ g H2O就可以将析出的沉淀溶解并恢复到原有浓度。

(1)写出b、c电极的电极反应式:b
(2)写出f电极的电极反应式
(3)闭合K一段时间后,丙装置的电解质溶液pH
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入
您最近一年使用:0次
2018-10-19更新
|
487次组卷
|
5卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高二上学期第一次月考化学试题
名校
3 . 如图所示,下图是原电池的装置图。请回答:___________ ;溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C的pH___________ (填“升高”“降低”或“基本不变”)。
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ ,B极电极反应式为___________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:___________ ,写出电极d的电极反应为___________ 。

(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

您最近一年使用:0次
4 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用电化学法制备,装置如图1所示,含Fe的催化电极反应机理如图2所示,不考虑溶液体积的变化。下列说法正确的是
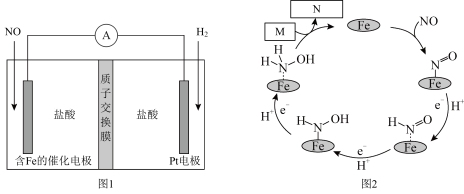

| A.电池工作时,Pt电极为正极 |
| B.图2中,M为H+,N为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况)左室溶液质量增加3.3g |
| D.电池工作一段时间后,正极区溶液的pH减小 |
您最近一年使用:0次
名校
解题方法
5 . 环氧乙烷( )可用于生产乙二醇。电化学合成环氧乙烷(
)可用于生产乙二醇。电化学合成环氧乙烷( )的装置如图所示:
)的装置如图所示:

已知:
| A.Pt电极接电源正极 |
| B.制备1mol环氧乙烷,Ni电极区产生2molH2 |
| C.Pt电极区的反应方程式为:CH2=CH2+Br2+H2O→HOCH2CH2Br |
| D.电解完成后,将阳极区和阴极区溶液混合才可得到环氧乙烷 |
您最近一年使用:0次
名校
6 . 完成下列问题。
(1)已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
当 和
和 化合生成2mol
化合生成2mol 时,放出
时,放出_______ kJ的能量。
(2)利用 与
与 的反应设计氢氧燃料电池,装置如图所示。
的反应设计氢氧燃料电池,装置如图所示。 的电极是电池的
的电极是电池的_______ (填“正”或“负”)极。
②通入 的电极反应式是
的电极反应式是_______ 。
(3)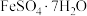 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁粉精和硫酸。
在氧气中掺烧可联合制备铁粉精和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如下图。利用
在氧气中燃烧的能量示意图如下图。利用 作为
作为 分解的燃料,从能源及资源利用的角度说明该工艺的优点
分解的燃料,从能源及资源利用的角度说明该工艺的优点_______ 。
(1)已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
| 化学键 |  |  |  |
键能/ | 436 | 498 | 463 |
 和
和 化合生成2mol
化合生成2mol 时,放出
时,放出(2)利用
 与
与 的反应设计氢氧燃料电池,装置如图所示。
的反应设计氢氧燃料电池,装置如图所示。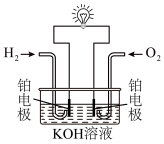
 的电极是电池的
的电极是电池的②通入
 的电极反应式是
的电极反应式是(3)
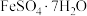 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁粉精和硫酸。
在氧气中掺烧可联合制备铁粉精和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如下图。利用
在氧气中燃烧的能量示意图如下图。利用 作为
作为 分解的燃料,从能源及资源利用的角度说明该工艺的优点
分解的燃料,从能源及资源利用的角度说明该工艺的优点
您最近一年使用:0次
名校
7 . 氮及其化合物在化肥、医药、材料和国防工业中具有广泛应用。回答下列问题:
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类温饱问题做出了极大贡献。写出实验室制备氨气的方程式_______________ 。
(2)有人设想寻求合适的催化剂和电极材料,以 、
、 为电极反应物,以HCl、
为电极反应物,以HCl、 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型电池,如图所示。________ (选填“正极”、“负极”);该电池正极的电极反应式是________________ 。
(3)盐酸羟胺(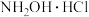 )主要用作还原剂和定影剂,是一种易溶于水的盐。以
)主要用作还原剂和定影剂,是一种易溶于水的盐。以 、
、 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。_____________________ 。
②该电池在工作过程中 的浓度变化为
的浓度变化为_______ (选填“增大”、“减小”、“不变”),假设放电过程中电解质溶液的体积不变,当右室溶液质量增加5.1g时,消耗 的物质的量为
的物质的量为_________ 。
(4) 电化学传感器是将环境中
电化学传感器是将环境中 浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融
浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融 和YSZ之间的界面X会生成固体
和YSZ之间的界面X会生成固体 。
。 向
向___________ (填正极或负极)。
②写出金属电极b发生的电极反应式:_______________________ 。
(1)自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类温饱问题做出了极大贡献。写出实验室制备氨气的方程式
(2)有人设想寻求合适的催化剂和电极材料,以
 、
、 为电极反应物,以HCl、
为电极反应物,以HCl、 为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型电池,如图所示。
为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型电池,如图所示。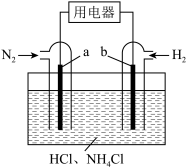
(3)盐酸羟胺(
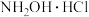 )主要用作还原剂和定影剂,是一种易溶于水的盐。以
)主要用作还原剂和定影剂,是一种易溶于水的盐。以 、
、 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。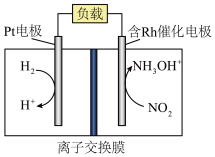
②该电池在工作过程中
 的浓度变化为
的浓度变化为 的物质的量为
的物质的量为(4)
 电化学传感器是将环境中
电化学传感器是将环境中 浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融
浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融 和YSZ之间的界面X会生成固体
和YSZ之间的界面X会生成固体 。
。
 向
向②写出金属电极b发生的电极反应式:
您最近一年使用:0次
名校
解题方法
8 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮物质和含氯物质的价类二维图如下,回答下列问题:
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:___________ 为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成___________ molO2。
(3)在常温下铁、铜与e的浓溶液组成原电池。
①请在下面方框中画出该原电池的装置图。要求:注明电解质溶液名称、正负极材料,并标出电子移动方向。___________ ___________ ;负极反应式:___________ 。
(4)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:___________ 。
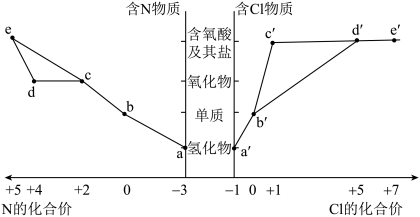
| A.a和c可在一定条件下反应生成b |
| B.工业上通过a→b→d→e来制备HNO3 |
| C.浓的a'溶液和浓的c'溶液反应可以得到b' |
| D.a和a'在空气中相遇产生白烟 |
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
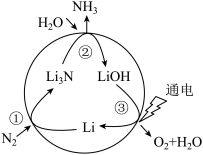
b.参与该人工固氮转化的物质中含有的化学键类型有
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成
(3)在常温下铁、铜与e的浓溶液组成原电池。
①请在下面方框中画出该原电池的装置图。要求:注明电解质溶液名称、正负极材料,并标出电子移动方向。

(4)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 根据题中提供的信息,请回答下列问题:
(1)学习原电池原理后,小江同学根据反应 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是______ ,正极材料可能是______ (填一种)。
(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。______ 。
②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为______ g。
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。______ 。
②该电池工作时,电解质溶液中 的移动方向是
的移动方向是______ 。(填“a向b”或“b向a”,下同),外电路中电子的流动方向是______ 。
③若将a极通入的气体换为 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为______ 。当a极有1mol 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为______ L。
(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。
(1)学习原电池原理后,小江同学根据反应
 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。

②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。

②该电池工作时,电解质溶液中
 的移动方向是
的移动方向是③若将a极通入的气体换为
 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备
 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。| A.将稀硫酸换成质量分数为98%的浓硫酸 | B.向反应液中滴入几滴硫酸铜溶液 |
| C.改换合适的装置并适当加热 | D.将锌粒换成质量相等的锌粉 |
您最近一年使用:0次
名校
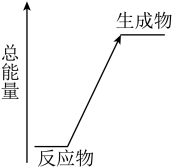
10 . 化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应,回答(1)和(2)。 晶体与
晶体与 晶体反应
晶体反应
c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是______ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量______ (填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整______ 。
②证实化学能转化为电能的实验现象是______ .
③正极的电极反应式是______ .______ .
(4) 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的______ 极(填“正”或“负”),通入 的一端发生的电极反应式为
的一端发生的电极反应式为______ 。生成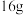 甲醇时,转移
甲醇时,转移______  电子。
电子。
 晶体与
晶体与 晶体反应
晶体反应c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
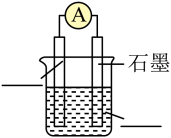
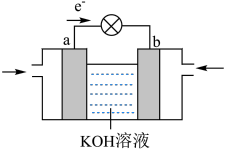
(1)以上化学反应中能用上图表示其能量变化的是
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整
②证实化学能转化为电能的实验现象是
③正极的电极反应式是
(4)
 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的 的一端发生的电极反应式为
的一端发生的电极反应式为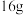 甲醇时,转移
甲醇时,转移 电子。
电子。
您最近一年使用:0次



