解题方法
1 . 多原子分子或离子的键角是一定的。下列分子中键角由大到小排列顺序正确的是
①SiCl2 ②OF2 ③H2O ④BF3 ⑤CS2
①SiCl2 ②OF2 ③H2O ④BF3 ⑤CS2
| A.⑤②③①④ | B.③②⑤④① | C.①④②⑤③ | D.⑤④①③② |
您最近一年使用:0次
解题方法
2 . 臭氧(O3)在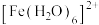 催化下能将烟气中的SO2、NOx分别氧化为
催化下能将烟气中的SO2、NOx分别氧化为 和
和 ,
, ,也可在其他条件下被还原为N2。下列说法正确的是
,也可在其他条件下被还原为N2。下列说法正确的是
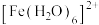 催化下能将烟气中的SO2、NOx分别氧化为
催化下能将烟气中的SO2、NOx分别氧化为 和
和 ,
, ,也可在其他条件下被还原为N2。下列说法正确的是
,也可在其他条件下被还原为N2。下列说法正确的是| A.第一电离能:O>N |
B. 中心原子轨道的杂化类型为sp3 中心原子轨道的杂化类型为sp3 |
C. 的空间构型为三角锥形 的空间构型为三角锥形 |
D. 分子中 分子中 键与 键与 键的数目比为1:2 键的数目比为1:2 |
您最近一年使用:0次
3 . 已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)X对应单质的化学式为_______ ,基态Y原子核外电子排布式为_______ 。
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为_______ 。
(3)上述五种元素中第一电离能最小的是_______ (填元素符号,下同);W、X、Z三种元素的电负性由大到小的顺序为_______ 。
(4)N2X与N2Z的熔点更高的是_______ 。(填化学式),原因是_______ 。
(5)ZX 和ZX
和ZX 中键角较小的是
中键角较小的是_______ (用离子符号表示),原因是_______ 。
| 元素 | 元素性质或原子结构或离子结构 |
| W | 原子核内无中子 |
| X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在同周期中最大 |
| Z | 基态原子核外有9种不同空间运动状态的电子,且有2个未成对电子 |
| N | N+的M层全充满 |
(1)X对应单质的化学式为
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为
(3)上述五种元素中第一电离能最小的是
(4)N2X与N2Z的熔点更高的是
(5)ZX
 和ZX
和ZX 中键角较小的是
中键角较小的是
您最近一年使用:0次
名校
解题方法
4 . 碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。设NA代表阿伏加德罗常数的值。粗硅的制备方法有两种:
方法一:
方法二:
(1)基态Si原子中存在_______ 对自旋状态相反的电子,基态Mg原子的最外层电子的电子云轮廓图是_______ 。
(2)上述2个反应中,涉及的所有元素中第一电离能最小的_______ (填元素符号)。
(3)C (金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序_______ ,其原因是_______ 。
(4)CO在配合物中可作为配体,在 配合物中配位原子是
配合物中配位原子是_______ (填元素符号),1 mol该配合物中含有π键的数目是_______ 。
(5)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si键中间插入O原子而形成。
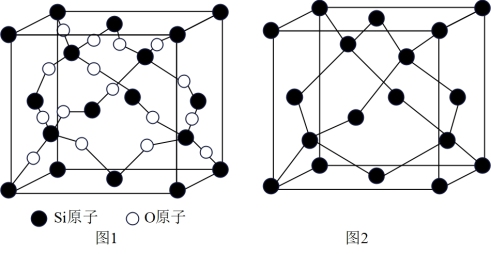
①SiO2晶胞中Si采取_______ 杂化,含有_______ 个O原子。
②SiO2晶胞中假设金刚石晶胞的边长为a pm,试计算该晶胞的密度_______  (写出表达式即可)
(写出表达式即可)
方法一:

方法二:

(1)基态Si原子中存在
(2)上述2个反应中,涉及的所有元素中第一电离能最小的
(3)C (金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序
(4)CO在配合物中可作为配体,在
 配合物中配位原子是
配合物中配位原子是(5)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si键中间插入O原子而形成。

①SiO2晶胞中Si采取
②SiO2晶胞中假设金刚石晶胞的边长为a pm,试计算该晶胞的密度
 (写出表达式即可)
(写出表达式即可)
您最近一年使用:0次
2022-04-16更新
|
78次组卷
|
2卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)
名校
5 . 心是用来碎的,周期表是用来背的,X、Y、Z、W、E、F是元素周期表中前四周期元素,原子序数依次增大,结合表中所给信息,请回答下列问题。
(1)ZX 的空间构型为
的空间构型为_______ ,ZX3的VSEPR模型为_______ ,ZX3极易溶于水的原因是_______ ;
(2)X、Y、Z、W四种元素中第一电离能最大的是_______ ,电负性最大的是_______ (填元素符号);
(3)YW和Z2的结构相似,在YW分子中,Y与W之间形成_______ 个σ键_______ 个π键;
(4)E元素位于周期表的_______ 区,原子的价层电子排布式为_______ ;
(5)F2+在水溶液中呈蓝色是因为形成了水合铜离子,其化学式为_______ ,提供孤电子对的是_______ ;
| 原子 | 结构特征 |
| X | 原子核外只有一个质子 |
| Y | 原子中有三个能级,且电子数目相等 |
| Z | 其原子的2p轨道为半充满 |
| W | 其单质之一是极性分子 |
| E | 价电子层有6个电子且均未成对 |
| F | 第29号元素 |
 的空间构型为
的空间构型为(2)X、Y、Z、W四种元素中第一电离能最大的是
(3)YW和Z2的结构相似,在YW分子中,Y与W之间形成
(4)E元素位于周期表的
(5)F2+在水溶液中呈蓝色是因为形成了水合铜离子,其化学式为
您最近一年使用:0次
2022-04-16更新
|
101次组卷
|
2卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(B卷)
名校
解题方法
6 . 碳及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)画出基态碳原子的价电子排布图:_______ 。
(2)1个 分子含有
分子含有_______ 个σ键; 的立体构型为
的立体构型为_______ ,写出一种与 具有相同立体构型的分子:
具有相同立体构型的分子:_______ (填化学式)。
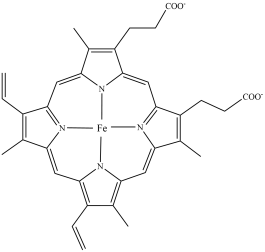
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。该结构中碳原子的杂化类型为_______ ,配位原子为_______ (填原子符号)。第一电离能: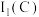
_______  (填“>”或“<”)。
(填“>”或“<”)。
(4)①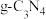 具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,
具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,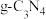 晶体中存在的微粒间作用力不包括
晶体中存在的微粒间作用力不包括_______ (填标号)。

a.非极性键 b.极性键 c.π键 d.范德华力
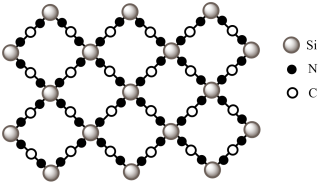
②用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物(如下图所示),该化合物的化学式为_______ 。
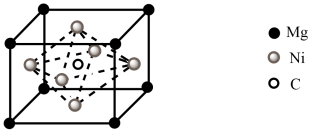
(5)C与Mg、Ni可形成一种新型超导体,其立方晶胞结构如下图所示。已知该晶胞密度为 ,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为
,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为_______ 。(用含a、b、c、 、
、 的代数式表示,其中
的代数式表示,其中 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)画出基态碳原子的价电子排布图:
(2)1个
 分子含有
分子含有 的立体构型为
的立体构型为 具有相同立体构型的分子:
具有相同立体构型的分子:(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。该结构中碳原子的杂化类型为
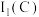
 (填“>”或“<”)。
(填“>”或“<”)。
(4)①
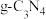 具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,
具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,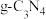 晶体中存在的微粒间作用力不包括
晶体中存在的微粒间作用力不包括
a.非极性键 b.极性键 c.π键 d.范德华力
②用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物(如下图所示),该化合物的化学式为

(5)C与Mg、Ni可形成一种新型超导体,其立方晶胞结构如下图所示。已知该晶胞密度为
 ,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为
,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为 、
、 的代数式表示,其中
的代数式表示,其中 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-03-31更新
|
926次组卷
|
3卷引用:山西省山西大学附属中学校2022届高三5月三模(总第七次)模块诊断考试理综化学试题
名校
7 . 请依据相关化学知识与原理完成下列各题。
(1)下列一组微粒中键角按由大到小的顺序排列为___________ (填编号)。
①HCN ② ③
③ ④
④  ⑤
⑤
(2) 、
、 、
、 、
、 中,Cl都是以
中,Cl都是以 杂化轨道方式与O原子成键,将它们的立体构型填入表格中:
杂化轨道方式与O原子成键,将它们的立体构型填入表格中:
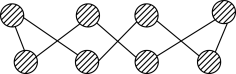
(3)S单质的常见形式为 ,其环状结构如图所示,S原子采用的轨道杂化方式是
,其环状结构如图所示,S原子采用的轨道杂化方式是___________ 杂化。
(4)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是___________ 杂化, 中的六个原子
中的六个原子___________ (填“在”或“不在”)同一个平面上。
(1)下列一组微粒中键角按由大到小的顺序排列为
①HCN ②
 ③
③ ④
④  ⑤
⑤
(2)
 、
、 、
、 、
、 中,Cl都是以
中,Cl都是以 杂化轨道方式与O原子成键,将它们的立体构型填入表格中:
杂化轨道方式与O原子成键,将它们的立体构型填入表格中:| 离子 |  |  |  |  |
| 立体构型 |
(3)S单质的常见形式为
 ,其环状结构如图所示,S原子采用的轨道杂化方式是
,其环状结构如图所示,S原子采用的轨道杂化方式是
(4)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。 分子中氮原子轨道的杂化类型是
分子中氮原子轨道的杂化类型是 中的六个原子
中的六个原子
您最近一年使用:0次
2022-03-25更新
|
602次组卷
|
2卷引用:山西省大同市灵丘县第一中学等名校2021-2022学年高二下学期3月联考化学试题
名校
解题方法
8 . 下列反应是合成某种抗肿瘤药物的一步,下列说法正确的是
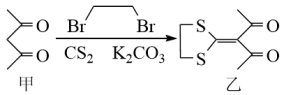

| A.乙分子有2个手性碳原子 |
B. 中阴离子的VSEPR模型为正四面体形 中阴离子的VSEPR模型为正四面体形 |
C.物质甲中含 键和 键和 键的数目之比为3:1 键的数目之比为3:1 |
D. 是由极性键构成的非极性分子 是由极性键构成的非极性分子 |
您最近一年使用:0次
2022-03-24更新
|
313次组卷
|
5卷引用:山西省运城市2021-2022学年高二下学期3月联考化学试题
名校
9 . 嘌呤类是含有氮的杂环结构的一类化合物,一种结构如图所示,关于这个平面分子描述错误的是


| A.分子结构中C和N原子的杂化方式均为sp2 |
| B.分子中只含有极性共价键 |
| C.轨道之间的夹角∠1比∠2大 |
| D.分子间可以形成氢键 |
您最近一年使用:0次
2022-03-21更新
|
112次组卷
|
2卷引用:山西省大同市灵丘县第一中学等名校2021-2022学年高二下学期3月联考化学试题
名校
解题方法
10 . CH 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是
 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是| A.—CH3与—NH2连接形成的化合物中,碳原子采取sp3杂化 |
B.CH 与NH3、H3O+的立体构型均为正四面体形 与NH3、H3O+的立体构型均为正四面体形 |
C.CH 中的碳原子采取sp3杂化,所有原子不都共面 中的碳原子采取sp3杂化,所有原子不都共面 |
D.CH 与OH-形成的化合物中含有离子键 与OH-形成的化合物中含有离子键 |
您最近一年使用:0次
2022-02-12更新
|
605次组卷
|
4卷引用:山西省太原市英才学校2022-2023学年高二下学期3月阶段测试化学试题
山西省太原市英才学校2022-2023学年高二下学期3月阶段测试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)四川省成都市实验外国语学校2021-2022学年高二下学期第一次阶段性考试化学试题四川省成都崇州市怀远中学2021-2022学年高二下学期期中考试化学试题



