名校
解题方法
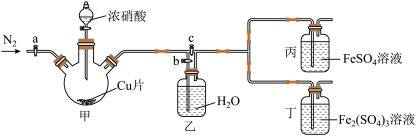
1 . 某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。回答下列问题。________ 。
(2)反应开始时装置甲中发生反应的离子方程式是________ 。
(3)关闭_____ (选填“a”“b”“c”),打开_____ (选填“a”“b”“c”)及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe²⁺反应。
(4)完成(3)中实验后,关闭分液漏斗活塞,打开a通一段时间N2,更新丙、丁中试剂,关闭a和b,打开c及分液漏斗活塞。反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应。对此你认为这个结论_______ (填“合理”“不合理”),理由是_______ (若你认为合理此空不用填)。
(5)实验结束后,同学们发现装置甲中溶液呈绿色,而不显蓝色。A同学认为是该溶液中硝酸铜的质量分数较高所致,而B同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验方案来判断两种看法是否正确。这些方案中可行的是______ (填字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
(2)反应开始时装置甲中发生反应的离子方程式是
(3)关闭
(4)完成(3)中实验后,关闭分液漏斗活塞,打开a通一段时间N2,更新丙、丁中试剂,关闭a和b,打开c及分液漏斗活塞。反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应。对此你认为这个结论
(5)实验结束后,同学们发现装置甲中溶液呈绿色,而不显蓝色。A同学认为是该溶液中硝酸铜的质量分数较高所致,而B同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验方案来判断两种看法是否正确。这些方案中可行的是
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
名校
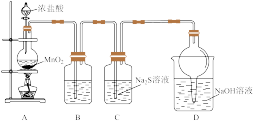
2 . 甲同学设计图1装置探究硫和氯的非金属性相对强弱。_______ 。B装置的作用是除去Cl2中的HCl,则B中的试剂是_______ (填名称),D装置的作用是_______ 。
(2)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:_______ 。通过实验证明氯的非金属性比硫强,则从原子结构角度的合理解释是_______ 。
(3)若利用上图装置探究碘和氯的非金属性相对强弱,需要改动的一处是_______ 。用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈_______ 色;打开分液漏斗活塞,却未见液体流下,原因可能是_______ 。
(2)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:
(3)若利用上图装置探究碘和氯的非金属性相对强弱,需要改动的一处是
您最近一年使用:0次
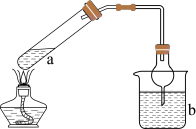
3 . 实验室中利用如图所示装置(夹持装置略)制备 并进行实验探究。
并进行实验探究。
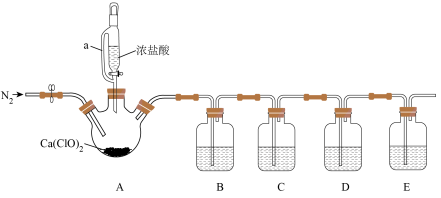
已知:C中试剂为滴有KSCN溶液的 溶液;D中试剂为
溶液;D中试剂为 的饱和溶液。
的饱和溶液。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)写出装置A中生成 的化学方程式:
的化学方程式:___________ 。
(3)实验中观察到C中溶液先变红后褪色。
①溶液变红的原因为___________ 。
②溶液褪色的原因可能是___________ ,设计实验验证该猜想:___________ 。
(4)反应一段时间后,取D中适量溶液,加入 溶液,有白色沉淀生成。该实验能否证明氯气具有氧化性
溶液,有白色沉淀生成。该实验能否证明氯气具有氧化性___________ (填“能”或“不能”),若能,说明理由;若不能,请设计实验证明:___________ 。
 并进行实验探究。
并进行实验探究。
已知:C中试剂为滴有KSCN溶液的
 溶液;D中试剂为
溶液;D中试剂为 的饱和溶液。
的饱和溶液。回答下列问题:
(1)仪器a的名称为
(2)写出装置A中生成
 的化学方程式:
的化学方程式:(3)实验中观察到C中溶液先变红后褪色。
①溶液变红的原因为
②溶液褪色的原因可能是
(4)反应一段时间后,取D中适量溶液,加入
 溶液,有白色沉淀生成。该实验能否证明氯气具有氧化性
溶液,有白色沉淀生成。该实验能否证明氯气具有氧化性
您最近一年使用:0次
2023高三·全国·专题练习
4 . Ⅰ.某实验小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。
实验操作:向小试管中加入 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,试管中溶液立即变蓝,取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝,取上层清液检验,证明溶液中存在 ,回答下列问题
,回答下列问题
(1) 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(2)检验该溶液中存在 的具体操作及现象为
的具体操作及现象为_______ 。
(3)实验结论: 的氧化性
的氧化性_______ (填“强于”或“弱于”)I2。
已知:I2可与 发生反应:
发生反应: ,为了进一步探究
,为了进一步探究 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:
(4)上述实验b中的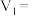
_______ ;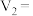
_______ 。
加入 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1: 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率;
反应的速率;
猜想2: 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应。
反应。
为验证上述猜想,小组同学补充下表实验:
(5)验证猜想1的实验设计为_______ (填“实验c”或“实验d”下同),验证猜想2的实验设计为_______ 。
(6)实验c中下层溶液显浅紫色的原因为_______ 。
(7)由上述实验可知_______ (填“猜想1”或“猜想2”)成立。
Ⅱ.Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体,其制备工艺流程
如下:
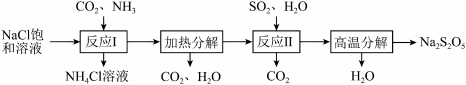
(8)Na2S2O5的名称为_______ (选填“焦硫酸钠”或“焦亚硫酸钠”)。
(9)“反应I ”中应先通入的气体是_______ ,反应后析出的固体产物是_______ 。
(10)“反应Ⅱ”的化学方程式为_______ 。
(11)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是_______ (任答一条即可)。
②若检验产品中含有杂质Na2CO3,下列试剂的使用顺序依次为_______ (填编号)。
a.稀硫酸 b.澄清石灰水 c.品红溶液 d.酸性KMnO4溶液
(12)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为_______ 。
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为_______ 。
实验操作:向小试管中加入
 溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,试管中溶液立即变蓝,取上层清液检验,证明溶液中存在
溶液,试管中溶液立即变蓝,取上层清液检验,证明溶液中存在 ,回答下列问题
,回答下列问题(1)
 与
与 反应的离子方程式为
反应的离子方程式为(2)检验该溶液中存在
 的具体操作及现象为
的具体操作及现象为(3)实验结论:
 的氧化性
的氧化性已知:I2可与
 发生反应:
发生反应: ,为了进一步探究
,为了进一步探究 与
与 的反应速率,小组同学设计下表实验:
的反应速率,小组同学设计下表实验:| 试验编号 | 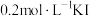 溶液/ 溶液/ | 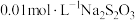 溶液/ 溶液/ | 蒸馏水/ | 0.4%的淀粉溶液/滴 | 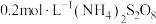 溶液/ 溶液/ | 变色时间/s |
| a | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| b | 4.0 | 1.0 |  | 2 |  | 30 |
(4)上述实验b中的
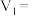
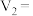
加入
 溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:猜想1:
 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率;
反应的速率;猜想2:
 先与
先与 反应,
反应, 消耗完后才与
消耗完后才与 反应。
反应。为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 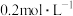  溶液/ 溶液/ |   碘水/ 碘水/ |   溶液/ 溶液/ |  / / | 0.4%的淀粉溶液/滴 | 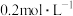 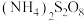 溶液/ 溶液/ | 实验现象 |
| c | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| d | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(5)验证猜想1的实验设计为
(6)实验c中下层溶液显浅紫色的原因为
(7)由上述实验可知
Ⅱ.Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体,其制备工艺流程
如下:

(8)Na2S2O5的名称为
(9)“反应I ”中应先通入的气体是
(10)“反应Ⅱ”的化学方程式为
(11)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是
②若检验产品中含有杂质Na2CO3,下列试剂的使用顺序依次为
a.稀硫酸 b.澄清石灰水 c.品红溶液 d.酸性KMnO4溶液
(12)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为
您最近一年使用:0次
解题方法
5 . Ⅰ.实验室欲用NaOH固体配制490mL 0.25mol·L−1的NaOH溶液。
回答下列问题:
(1)称取NaOH质量为___________ g。
(2)在配制的过程中一定不需要使用到的仪器是___________  填字母
填字母 ,还缺少的仪器有
,还缺少的仪器有___________ (填仪器名称)
A.烧杯 B.药匙 C.玻璃棒 D.托盘天平 E.锥形瓶 F.胶头滴管
(3)下列的实验操作可能导致配制的溶液浓度偏低的是___________  填字母
填字母 。
。
A.容量瓶内原来存有少量的水未进行干燥
B. 称量固体时,所用砝码已生锈
C. NaOH固体溶解后,未冷却至室温就开始进行转移
D. 定容时仰视视刻度线
E.定容时液面超过刻度线,用胶头滴管吸出
Ⅱ.某学习小组为探究CO2与过氧化钠反应时是否需要与水接触,设计了如下实验装置
步骤1:先打开K2,关闭K1,然后打开分液漏斗活塞加入盐酸,一段时间后,将带火星的木条放在a处。
步骤2:先打开K1,关闭K2,然后打开分液漏斗活塞加入盐酸,一段时间后,将带火星的木条放在a处。
(4)装置②是为了除去CO2中的HCl气体,所选试剂是___________ (填字母)。
A.浓H2SO4 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(5)从上述试剂中选择,装置③中的试剂是___________ (填字母),其作用为___________ 。
(6)甲同学根据实验现象认为:CO2与过氧化钠反应时需要与水接触。据此推断他观察到的步骤1和步骤2的a处的实验现象分别是___________ 。
(7)乙同学对此结论提出质疑,他认为:上述实验不足以证明“有水存在时,过氧化钠与CO2发生了化学反应”。用化学方程式表示乙同学的理由___________ 。
回答下列问题:
(1)称取NaOH质量为
(2)在配制的过程中一定不需要使用到的仪器是
 填字母
填字母 ,还缺少的仪器有
,还缺少的仪器有A.烧杯 B.药匙 C.玻璃棒 D.托盘天平 E.锥形瓶 F.胶头滴管
(3)下列的实验操作可能导致配制的溶液浓度偏低的是
 填字母
填字母 。
。A.容量瓶内原来存有少量的水未进行干燥
B. 称量固体时,所用砝码已生锈
C. NaOH固体溶解后,未冷却至室温就开始进行转移
D. 定容时仰视视刻度线
E.定容时液面超过刻度线,用胶头滴管吸出
Ⅱ.某学习小组为探究CO2与过氧化钠反应时是否需要与水接触,设计了如下实验装置

步骤1:先打开K2,关闭K1,然后打开分液漏斗活塞加入盐酸,一段时间后,将带火星的木条放在a处。
步骤2:先打开K1,关闭K2,然后打开分液漏斗活塞加入盐酸,一段时间后,将带火星的木条放在a处。
(4)装置②是为了除去CO2中的HCl气体,所选试剂是
A.浓H2SO4 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(5)从上述试剂中选择,装置③中的试剂是
(6)甲同学根据实验现象认为:CO2与过氧化钠反应时需要与水接触。据此推断他观察到的步骤1和步骤2的a处的实验现象分别是
(7)乙同学对此结论提出质疑,他认为:上述实验不足以证明“有水存在时,过氧化钠与CO2发生了化学反应”。用化学方程式表示乙同学的理由
您最近一年使用:0次
6 . 利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是
a中反应 | b中检测试剂及现象 | |
A | Cu与浓 生成 生成 | 品红溶液褪色 |
B | C与浓 生成 生成 | 澄清石灰水变浑浊 |
C | 铁钉与浓 生成 生成 | 淀粉-KI溶液变蓝 |
D | 浓NaOH与 溶液生成 溶液生成 | 酚酞溶液变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 实验小组制备高铁酸钾 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略) 中反应的化学方程式是
中反应的化学方程式是 ___________ (锰被还原为 )。
)。
②将除杂装置 补充完整并标明所用试剂。
补充完整并标明所用试剂。___________
③ 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有___________ (离子方程式)。
(2)探究 的性质
的性质
①取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案 中溶液变红可知
中溶液变红可知 中含有
中含有___________ 离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由___________ 产生(用离子方程式表示)。
ii.方案 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性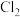
___________ 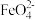 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性
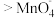 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性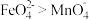 ,请说明理由:
,请说明理由:___________ 。
 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
 中反应的化学方程式是
中反应的化学方程式是  )。
)。②将除杂装置
 补充完整并标明所用试剂。
补充完整并标明所用试剂。③
 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有(2)探究
 的性质
的性质①取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:方案 | 取少量 ,滴加 ,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
方案 | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量 溶出,得到紫色溶液b。取少量 ,滴加盐酸,有 ,滴加盐酸,有 产生。 产生。 |
 中溶液变红可知
中溶液变红可知 中含有
中含有 将
将 氧化,还可能由
氧化,还可能由ii.方案
 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性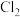
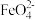 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性

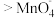 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性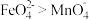 ,请说明理由:
,请说明理由:
您最近一年使用:0次
名校
解题方法
8 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
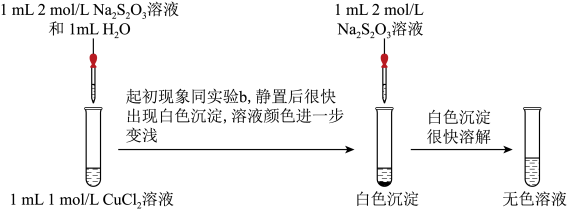
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近一年使用:0次
9 . 兴趣小组查阅文献后,设计实验对苯酚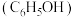 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
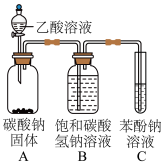
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
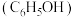 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近一年使用:0次
2024-04-26更新
|
167次组卷
|
2卷引用:北京市北京大学附属中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
10 . 某校研究性学习小组设计实验,验证草酸受热分解的产物。已知:①草酸是一种弱酸,草酸晶体(H2C2O4·2H2O)易溶于水,受热易熔化、气化和分解。②草酸分解产生 和
和 。③草酸钙
。③草酸钙 是白色固体,难溶于水。
是白色固体,难溶于水。
(1)草酸中含有的化学键类型是____________ ,草酸晶体分解的化学方程式是____________ 。
(2)验证草酸分解的产物用到下列仪器,仪器的连接顺序是____________ (仪器可重复使用);A装置的作用是____________ ,该套装置___________ (填“是”或“否”)完善,说明理由____________ 。 的仪器名称是
的仪器名称是___________ 。
(4)证明有 生成的现象是
生成的现象是___________ 。
 和
和 。③草酸钙
。③草酸钙 是白色固体,难溶于水。
是白色固体,难溶于水。(1)草酸中含有的化学键类型是
(2)验证草酸分解的产物用到下列仪器,仪器的连接顺序是
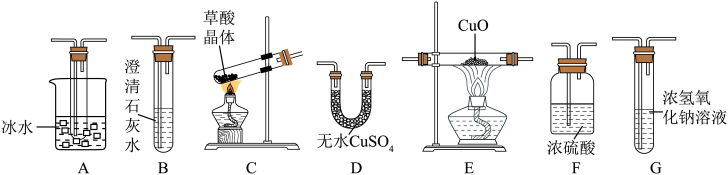
 的仪器名称是
的仪器名称是(4)证明有
 生成的现象是
生成的现象是
您最近一年使用:0次
2024-04-23更新
|
60次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高一下学期3月阶段测试化学试题






