名校
解题方法
1 . 甲基丙烯酸甲酯是合成有机玻璃的单体,有关物质的性质如下:
某小组拟制备甲基丙烯酸甲酯并探究其性质,装置如图所示(夹持及加热仪器略)。

向三颈瓶中依次加入20 mL甲醇、5 mL浓硫酸、30 mL甲基丙烯酸及沸石少许,充分搅拌,加热。
(1)向其中加入沸石的目的是___________ 。
(2)使用油水分离器的作用是___________ 。
(3)实验结束后,提纯产品的流程如下:
混合液 产品
产品
①水洗2的目的是___________ 。
②加入硫酸钠粉末的作用是___________ 。
③蒸馏操作中收集产品的温度约为___________ 。
(4)设计简单实验检验产品中含碳碳双键:___________ 。
(5)甲基丙烯酸甲酯另一种合成方法为 ,已知该反应的原子利用率为100%,则A的结构简式为
,已知该反应的原子利用率为100%,则A的结构简式为___________ 。
| 物质 | 沸点/℃ | 溶解性 |
| 甲醇 | 64.7 | 易溶于水和有机溶剂 |
甲基丙烯酸 | 161 | 溶于水,易溶于有机溶剂 |
| 甲基丙烯酸甲酯 | 100 | 易溶于有机溶剂,微溶于水 |

向三颈瓶中依次加入20 mL甲醇、5 mL浓硫酸、30 mL甲基丙烯酸及沸石少许,充分搅拌,加热。
(1)向其中加入沸石的目的是
(2)使用油水分离器的作用是
(3)实验结束后,提纯产品的流程如下:
混合液
 产品
产品①水洗2的目的是
②加入硫酸钠粉末的作用是
③蒸馏操作中收集产品的温度约为
(4)设计简单实验检验产品中含碳碳双键:
(5)甲基丙烯酸甲酯另一种合成方法为
 ,已知该反应的原子利用率为100%,则A的结构简式为
,已知该反应的原子利用率为100%,则A的结构简式为
您最近一年使用:0次
名校
2 . 氨基甲酸铵(NH2COONH4)是一种重要的医用氨化剂,有关该物质的信息如下表所示:
某实验小组在实验室中利用下列装置合成少量的氨基甲酸铵。回答下列问题:
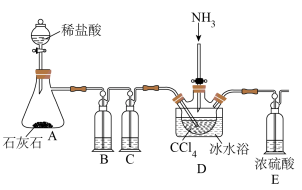
(1)盛放稀盐酸的仪器的名称是___________ 。
(2)装置B和C中试剂的名称分别是___________ 、___________ 。
(3)实验室制取氨气的化学方程式为___________ 。
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是___________ 。
(5)装置E的作用有___________ (写出两点)。若观察到E中出现大量气泡(浓硫酸足量),则可能的原因是___________ 。
(6)设计实验:检验制得的产品中是否混有 ?
?___________ 。
| 制备原理 | 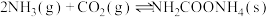 放热反应 放热反应 |
| 主要性质 | ①在潮湿的空气中转变为 ②温度较高时容易分解生成  、 、 ③不溶于  |

(1)盛放稀盐酸的仪器的名称是
(2)装置B和C中试剂的名称分别是
(3)实验室制取氨气的化学方程式为
(4)反应结束后,从三颈烧瓶中分离出产品,进行的实验操作是
(5)装置E的作用有
(6)设计实验:检验制得的产品中是否混有
 ?
?
您最近一年使用:0次
2023-07-14更新
|
78次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期开学化学试题
3 . 苯酚是重要的化工原料,有关苯酚的实验如下:
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:
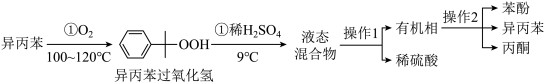
(1)异丙苯氧化过程①温度不能过高的原因是___________ 。
(2)检验有机相中是否含有水的试剂是___________ 。
(3)“操作1”的名称是___________ 。
(Ⅱ)苯酚的实验探究
探究铁盐种类和 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:ⅰ.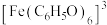 为紫色;
为紫色;
ⅱ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅲ.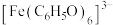 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与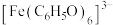 的浓度在一定范围内成正比
的浓度在一定范围内成正比
ⅳ.苯酚与 的显色原理:
的显色原理:
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
猜想3: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
进行实验:常温下,用盐酸调节配制得到 分别为a和b的
分别为a和b的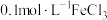 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的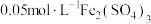 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为 。
。
(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是___________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂: 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体)
③小组同学得出实验结果为: ,
,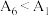 ,由此得出此结论是
,由此得出此结论是___________ 。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是___________ 。
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:

(1)异丙苯氧化过程①温度不能过高的原因是
(2)检验有机相中是否含有水的试剂是
(3)“操作1”的名称是
(Ⅱ)苯酚的实验探究
探究铁盐种类和
 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。查阅资料:ⅰ.
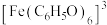 为紫色;
为紫色;ⅱ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅲ.
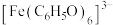 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与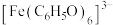 的浓度在一定范围内成正比
的浓度在一定范围内成正比ⅳ.苯酚与
 的显色原理:
的显色原理:
提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。猜想3:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。进行实验:常温下,用盐酸调节配制得到
 分别为a和b的
分别为a和b的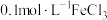 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的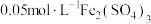 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。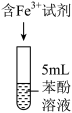 | 序号 | 含 的试剂 的试剂 | 吸光度 | |
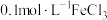 溶液 溶液 | 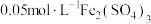 溶液 溶液 | |||
| 1 |  | / |  | |
| 2 |  | / |  | |
| 3 | / |  |  | |
| 4 | / |  |  | |
 。
。(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:
 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体) | 序号 | 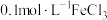 溶液 溶液 | 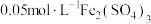 溶液 溶液 | 再加试剂 | 吸光度 |
| 5 | / |  |  固体 固体 | 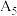 | |
| 6 |  | / | 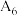 |
 ,
,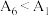 ,由此得出此结论是
,由此得出此结论是④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
您最近一年使用:0次
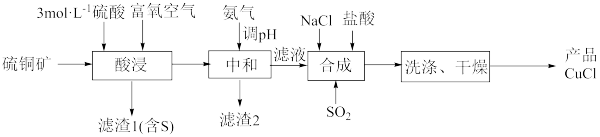
4 . 一种用硫铜矿(主要含CuS、 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成 ;
;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为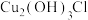 ;
;
③已知 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:
回答下列问题:
(1)“酸浸”时,富氧空气的作用_______ 。
(2)“酸浸”时,CuS反应的化学方程式为_______ 。
(3)用氨水调pH时,应将溶液的范围调整为_______ 。
(4)“合成”时, 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为_______ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为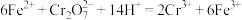
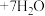 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为_______ (杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
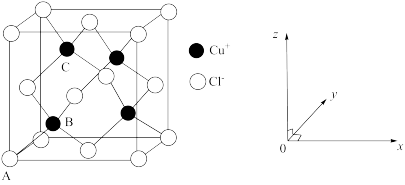
①图中原子的坐标参数:A为 ,B为
,B为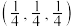 ,则C的坐标参数为
,则C的坐标参数为_______ 。
② 与
与 最短的距离是
最短的距离是_______ nm。
 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成
 ;
;②CuCl在潮湿的空气中易被氧化,生成的碱式盐为
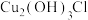 ;
;③已知
 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:| 金属离子 |  |  |  |
| 开始沉淀pH | 4.7 | 8.1 | 1.2 |
| 完全沉淀pH | 6.7 | 9.6 | 3.2 |
(1)“酸浸”时,富氧空气的作用
(2)“酸浸”时,CuS反应的化学方程式为
(3)用氨水调pH时,应将溶液的范围调整为
(4)“合成”时,
 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为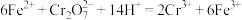
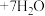 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。

①图中原子的坐标参数:A为
 ,B为
,B为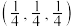 ,则C的坐标参数为
,则C的坐标参数为②
 与
与 最短的距离是
最短的距离是
您最近一年使用:0次
2023-04-11更新
|
515次组卷
|
4卷引用:河南省驻马店高级中学2022-2023学年高二下学期期中考试化学试题
5 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[ mol·L
mol·L ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将_______ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ 。
(4)“除杂1”的目的是_______ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是_______ 。
(6)“沉锰”时会产生无色无味的一种气体,写出“沉锰”的离子方程式_______ 。
(7)由图像可知,从“操作A”所得溶液中得到 晶体需进行的操作是
晶体需进行的操作是_______ 、洗涤、干燥。若称取一定质量的 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是_______ 。


相关金属离子[
 mol·L
mol·L ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的
 的作用是将
的作用是将(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是
(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)“沉锰”时会产生无色无味的一种气体,写出“沉锰”的离子方程式
(7)由图像可知,从“操作A”所得溶液中得到
 晶体需进行的操作是
晶体需进行的操作是 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
您最近一年使用:0次
名校
解题方法
6 . 亚硝酰氯(NOCl)可用做有机合成试剂。某研究小组用NO和Cl2制备NOCl,并分离回收未反应的原料,装置如图(夹持及加热装置已略去)。
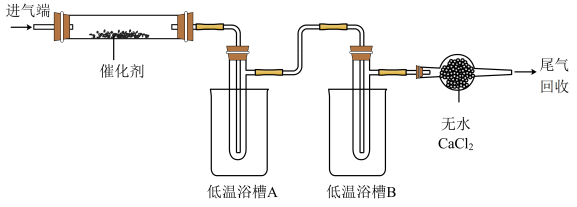
已知:① ;
;
②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是

已知:①
 ;
;②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是
| A.实验前先通入氩气,目的是排尽装置内的空气 |
| B.低温浴槽B的温度区间应控制在-34℃~-6℃ |
| C.将催化剂负载在玻璃棉上,以增大接触面积,提高反应速率 |
| D.尾气回收的物质为NO |
您最近一年使用:0次
2023-02-10更新
|
398次组卷
|
3卷引用:四川省成都外国语学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
7 . 二草酸合铜(Ⅱ)酸钾(K2[Cu(C2O4)2])可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的CuSO4溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。
Ⅲ将Ⅱ的混合溶液加热至80~85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
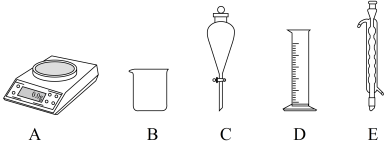
(1)由CuSO4•5H2O配制Ⅰ中的CuSO4溶液,下列仪器中不需要的有________ (填对应字母)。
(2)长期存放的CuSO4•5H2O中,会出现少量白色固体,原因是_______ 。
(3)Ⅰ中的黑色沉淀可能是________ (写化学式)。
(4)Ⅱ中原料配比为n(H2C2O4):n(K2CO3)=3:2,写出反应的化学方程式______ 。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入K2CO3时应采取_______ 的方法。
(6)Ⅲ中应采用________ 进行加热。
(7)Ⅳ中“一系列操作”包括________ 。
Ⅰ.取已知浓度的CuSO4溶液,搅拌下滴加足量NaOH溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。
Ⅲ将Ⅱ的混合溶液加热至80~85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由CuSO4•5H2O配制Ⅰ中的CuSO4溶液,下列仪器中不需要的有

(2)长期存放的CuSO4•5H2O中,会出现少量白色固体,原因是
(3)Ⅰ中的黑色沉淀可能是
(4)Ⅱ中原料配比为n(H2C2O4):n(K2CO3)=3:2,写出反应的化学方程式
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入K2CO3时应采取
(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
您最近一年使用:0次
名校
解题方法
8 . 二草酸合铜(II)酸钾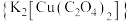 可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:
可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:
I.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
II.向草酸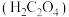 溶液中加入适量
溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
III.将II的混合溶液加热至80~85℃,加入I中的黑色沉淀。全部溶解后,趁热过滤。
IV.将III的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(II)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由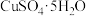 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是_______ (填仪器名称)。
(2)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是_______ 。
(3)I中的黑色沉淀是_______ (写化学式)。
(4)II中原料配比为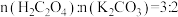 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(5)II中,为防止反应过于刚烈而引起喷溅,加入 应采取
应采取_______ 的方法。
(6)III中应采用_______ 进行加热。
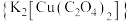 可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:
可用于无机合成、功能材料制备。实验室制备二草酸合铜(II)酸钾可采用如下步骤:I.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀,加热,沉淀转变成黑色,过滤。II.向草酸
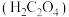 溶液中加入适量
溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。III.将II的混合溶液加热至80~85℃,加入I中的黑色沉淀。全部溶解后,趁热过滤。
IV.将III的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(II)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
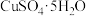 配制I中的
配制I中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是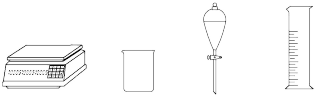
(2)长期存放的
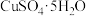 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)I中的黑色沉淀是
(4)II中原料配比为
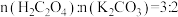 ,写出反应的化学方程式
,写出反应的化学方程式(5)II中,为防止反应过于刚烈而引起喷溅,加入
 应采取
应采取(6)III中应采用
您最近一年使用:0次
名校
9 . 三氯化铬(CrCl3,熔点83℃,易升华、水解,高温下易被氧气氧化)是合成其他铬盐的重要原料,在无机和有机合成中有重要作用,某同学在实验室加热Cr2O3与CCl4制备CrCl3。
(1)基态Cr原子核外有_______ 种能量不同的电子。
(2)Cr2O3的制备:将一定量的重铬酸铵[(NH4)2Cr2O7]放入坩埚中加热分解生成Cr2O3、N2和H2O。上述反应中氧化产物和还原产物的物质的量之比为_______ 。
(3)CrCl3的制备装置如图所示:

①仪器X的名称为_______ 。
②实验时,点燃酒精灯前需要先通入一段时间的N2,其目的是_______ 。
③装置B试管中除了生成CrCl3外,还有光气(COCl2)生成,光气有毒,与水反应生成大量酸雾,装置D烧杯中反应的化学方程式为_______ 。
(4)产品中CrCl3质量分数的测定,步骤如下:
(ⅰ)称取0.3000g CrCl3产品溶于水并于250mL容量瓶中定容;
(ⅱ)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O ,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
(ⅲ)加入1mL指示剂,用0.0250mol/L的标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①(ⅱ)中加入稍过量的Na2O2后需要加热煮沸,其主要原因是_______ 。
②滴定实验可选用的指示剂为_______ ;产品中CrCl3质量分数为_______ (计算结果保留四位有效数字)。
(1)基态Cr原子核外有
(2)Cr2O3的制备:将一定量的重铬酸铵[(NH4)2Cr2O7]放入坩埚中加热分解生成Cr2O3、N2和H2O。上述反应中氧化产物和还原产物的物质的量之比为
(3)CrCl3的制备装置如图所示:

①仪器X的名称为
②实验时,点燃酒精灯前需要先通入一段时间的N2,其目的是
③装置B试管中除了生成CrCl3外,还有光气(COCl2)生成,光气有毒,与水反应生成大量酸雾,装置D烧杯中反应的化学方程式为
(4)产品中CrCl3质量分数的测定,步骤如下:
(ⅰ)称取0.3000g CrCl3产品溶于水并于250mL容量瓶中定容;
(ⅱ)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O
 ,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;(ⅲ)加入1mL指示剂,用0.0250mol/L的标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①(ⅱ)中加入稍过量的Na2O2后需要加热煮沸,其主要原因是
②滴定实验可选用的指示剂为
您最近一年使用:0次
2023-01-05更新
|
110次组卷
|
2卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题
10 . 苯甲酸乙酯可用于配制香水及食用香精。实验室用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)。已知:

Ⅰ.合成苯甲酸乙酯粗产品按上图装置,在仪器C中加入2.44 g苯甲酸、15.0 mL乙醇、3.0 mL浓硫酸适量环己烷(与乙醇、水可形成共沸物),控制一定温度加热2 h后停止加热。
(1)本实验中制取苯甲酸乙酯的化学方程式为___________ 。
(2)结合数据分析,实验时使用过量乙醇的目的是___________ 。
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是___________ 。
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。
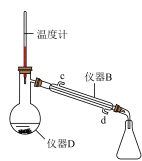
(4)仪器D的名称是___________ 。
(5)加入Na2CO3溶液的作用有___________ (填序号)。
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集___________ ℃的馏分。
(7)该实验中苯甲酸乙酯的产率是___________ (产率= ×100%)。
×100%)。

| 物质 | 乙醇 | 苯甲酸 | 乙醚 | 苯甲酸乙酯 |
| 密度/(g•cm﹣3) | 0.7893 | 1.2659 | 0.7318 | 1.0500 |
| 沸点/℃ | 78.5 | 249.0 | 34.5 | 212.0 |
| 相对分子质量 | 46 | 122 | 74 | 150 |
(1)本实验中制取苯甲酸乙酯的化学方程式为
(2)结合数据分析,实验时使用过量乙醇的目的是
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。

(4)仪器D的名称是
(5)加入Na2CO3溶液的作用有
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集
(7)该实验中苯甲酸乙酯的产率是
 ×100%)。
×100%)。
您最近一年使用:0次



