名校
解题方法
1 . 向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段:_______________________________________________ 。
第二阶段:_______________________________________________ 。
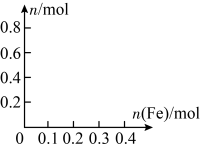
(2)在图中画出溶液中Fe2+、Fe3+、 的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)
的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量) ________ 。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段:
第二阶段:
(2)在图中画出溶液中Fe2+、Fe3+、
 的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)
的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量) 
您最近一年使用:0次
2016-12-09更新
|
424次组卷
|
2卷引用:2015-2016学年黑龙江省牡丹江中学高一上期末化学试卷
解题方法
2 . 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出A、C、F、G的化学式:A________ ,C________ ,F________ ,G________ 。
(2)检验D中阳离子的方法______________________________________________ 。
(3)保存C溶液时为什么要加固体A_____________________________________ 。
(4)写出下列转化的离子方程式C→D:____________________________________ 。

(1)写出A、C、F、G的化学式:A
(2)检验D中阳离子的方法
(3)保存C溶液时为什么要加固体A
(4)写出下列转化的离子方程式C→D:
您最近一年使用:0次
解题方法
3 . 硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)下列物质中最适合的氧化剂B是____________________ ;
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式____________________ 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由____________________ 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH 的方法是
的方法是____________________ 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为____________________ 。

请回答下列问题:
(1)下列物质中最适合的氧化剂B是
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由
(3)检验硫酸铁铵中NH
 的方法是
的方法是(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为
您最近一年使用:0次
2016-12-09更新
|
279次组卷
|
3卷引用:2015届湖南省衡阳市八中高三上学期月考理综化学试卷
11-12高三上·山东菏泽·期中
4 . 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
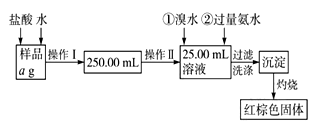
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________ 、________ (填仪器名称),操作Ⅱ必须用到的仪器是________ (填编号)。
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式__________ ,加入氨水要过量的原因是_________ 。
(3)检验沉淀是否已经洗涤干净的操作是___________________ 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是______________ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是__________________________ 。(写出一种原因即可)。

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式
(3)检验沉淀是否已经洗涤干净的操作是
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
您最近一年使用:0次
5 . 某铁的氧化物,用3.5mol/L的盐酸200mL在一定条件下恰好完全溶解,所得溶液再通入1.775g的氯气时,刚好使溶液中Fe2+完全转化为Fe3+.则该氧化物的化学式可表示为
| A.FeO |
| B.Fe3O4 |
| C.Fe4O5 |
| D.Fe5O7 |
您最近一年使用:0次
解题方法
6 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________ ,此法的最大缺点是__________ 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________ ;向混合溶液中通入热空气的反应的离子方程式是___________________ ;由滤液得到无水硫酸铜的实验操作是______________ 。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是_______________________ 。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________ 。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是
您最近一年使用:0次
2016-04-12更新
|
404次组卷
|
2卷引用:2015-2016学年四川省成都市龙泉一中高二下入学考试化学试卷
解题方法
7 . 铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用实验的方法。实验中称取0.54 g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值 (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
(1)要确定铁的某氯化物FeClx的化学式,可用实验的方法。实验中称取0.54 g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值 (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
您最近一年使用:0次



