名校
解题方法
1 . 下列物质的熔点高低顺序正确的是
| A.金刚石>石墨>晶体硅>碳化硅 |
| B.CH3CH2CH2CH2CH3>CH3C(CH3)2CH3 |
| C.HI>HBr>HCl>HF |
| D.黄铜>纯铜>钠>钾 |
您最近一年使用:0次
2024-03-31更新
|
135次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
2 . 下列关于各图像的解释或得出的结论不正确 的是

A.由甲图可知,反应在 时刻可能改变了压强或使用了催化剂 时刻可能改变了压强或使用了催化剂 |
| B.由乙图可知,反应在m点可能达到了平衡状态 |
C.由丙图可知,C点: |
D.由丁图可知,交点A表示反应一定处于平衡状态,此时 |
您最近一年使用:0次
2023-12-29更新
|
319次组卷
|
9卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题四川省资阳市2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2022-2023学年高二上学期第三次月考化学试题陕西省西北工业大学附属中学2022-2023学年高一下学期期末考试化学试题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题(已下线)广东省深圳中学2023-2024学年高二上学期11月期中考试化学试题河南省许昌高级中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
3 . 电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
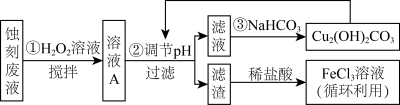
已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以___________ (任写一点)
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要___________
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为___________ 。
(4)FeCl3蚀刻液中加入盐酸的目的是___________ 。
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)___________ 。
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是___________ 。
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是___________ 。

已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为
(4)FeCl3蚀刻液中加入盐酸的目的是
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是
您最近一年使用:0次
名校
解题方法
4 . 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0°C,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:

(1)B装置使用的试液X为___________ ,其作用是___________ 。
(2)装置E的作用是___________ 。
(3)装置D中冰水的主要作用是___________ ,往D中通入氯气的同时还通入干燥的空气,其主要目的是___________ 。
(4)装置D内发生反应的化学方程式为___________ 。
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为___________ 。

(1)B装置使用的试液X为
(2)装置E的作用是
(3)装置D中冰水的主要作用是
(4)装置D内发生反应的化学方程式为
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
您最近一年使用:0次
5 . 丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g) _______。
_______。
②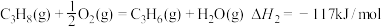
③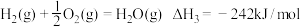
反应①的
___________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。
(3)能表明该反应①达到平衡状态的是___________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为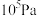 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为___________ 。该反应的平衡常数
___________ Pa.(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=___________ ;保持恒温恒容,将反应的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向”逆向”或“不”)移动,平衡常数K___________ (填“变大”变小”或“不变”)。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g)
 _______。
_______。②
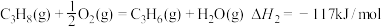
③
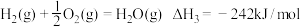
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
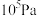 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=
您最近一年使用:0次
名校
6 . 为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:___________ 。
(2)A装置中发生反应的化学方程式为___________ ,F装置的烧杯中发生反应的离子方程式是___________ ,B装置中的现象是___________ 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是___________ 。
实验II:硫酸铜产率的测定
将铜与浓硫酸反应所得溶液配制成250.00mL溶液,取该溶液25.00mL置于锥形瓶中,向其中加入足量KI溶液和3~5滴淀粉溶液,摇匀,用0.3600mol/L的 溶液进行滴定。重复滴定3次,3次平均消耗该
溶液进行滴定。重复滴定3次,3次平均消耗该 溶液25.00mL。(已知:
溶液25.00mL。(已知: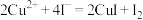 ,
, )
)
(4)达到滴定终点的现象是___________ 。
(5)若反应消耗铜的质量为6.4g,则硫酸铜的产率为___________ 。
(6)下列会导致测定结果偏大的是___________。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:

(2)A装置中发生反应的化学方程式为
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
实验II:硫酸铜产率的测定
将铜与浓硫酸反应所得溶液配制成250.00mL溶液,取该溶液25.00mL置于锥形瓶中,向其中加入足量KI溶液和3~5滴淀粉溶液,摇匀,用0.3600mol/L的
 溶液进行滴定。重复滴定3次,3次平均消耗该
溶液进行滴定。重复滴定3次,3次平均消耗该 溶液25.00mL。(已知:
溶液25.00mL。(已知: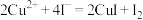 ,
, )
)(4)达到滴定终点的现象是
(5)若反应消耗铜的质量为6.4g,则硫酸铜的产率为
(6)下列会导致测定结果偏大的是___________。
A.配制 溶液定容时仰视 溶液定容时仰视 |
| B.滴定前锥形瓶未干燥 |
| C.滴定前滴定管尖嘴出现气泡,滴定终点时气泡消失 |
| D.滴定终点时,滴定管尖嘴悬挂一滴液滴 |
您最近一年使用:0次
2023-09-24更新
|
59次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . 下列指定反应的离子方程式正确的是
| A.碘化亚铁溶液通入少量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| B.用H2O2从酸化的海带灰浸出液中制取碘:2I-+H2O2+2H+=I2+2H2O |
C.Fe(OH)3胶体的制备:Fe3++3NH3•H2O=Fe(OH)3(胶体)+3NH |
D.等物质的量的NaHCO3溶液与Ca(OH)2溶液混合:2HCO +Ca2++2OH-=CaCO3↓+CO +Ca2++2OH-=CaCO3↓+CO |
您最近一年使用:0次
2023-09-17更新
|
709次组卷
|
3卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 如图所示为CFCl3破坏臭氧层的过程,下列说法不正确的是
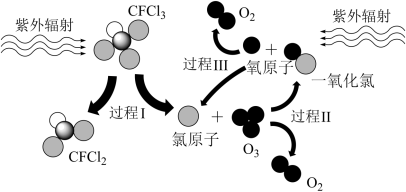
| A.过程Ⅰ中断裂C—Cl键 | B.过程Ⅱ可表示为O3+Cl=ClO+O2 |
| C.过程Ⅲ中O+O=O2是吸热过程 | D.上述过程说明CFCl3中的氯原子是破坏臭氧层的催化剂 |
您最近一年使用:0次
2023-09-13更新
|
206次组卷
|
62卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题河南省林州市第一中学2018届高三8月调研考试化学试题辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2北京市第十中学2019届高三第一学期10月月考化学试题北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题河北省张家口第一中学2019-2020学年高二9月月考化学试题北京市昌平区新学道临川学校2020届高三上学期期中考试化学试题陕西省西安中学2019-2020学年高二上学期期中考试化学试题山东省济南市历城二中2020届高三一轮复习验收化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编北京市通州区2020届高三第一次模拟考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题宁夏回族自治区银川一中2020届高三下学期第五次模拟考试理综化学试题安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高一下学期第三次月考化学试题湖南省岳阳市2019-2020学年高二下学期期末考试化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 章末综合检测卷江西省南昌市第二中学2020-2021学年高二上学期第一次月考化学试题河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山西省长治市第二中学校2020-2021学年高二上学期第一次月考化学试题北京首都师范大学第二附属中学2021届高三10月月考化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题海南儋州市第一中学2020-2021学年高二上学期第一次月考化学试题山东省烟台市中英文学校2021届高三上学期冬学竞赛化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化湖南省炎德英才大联考长沙市第一中学2021届高三上学期第五次月考化学试题宁夏六盘山市高级中学2020-2021学年高三下学期第二次模拟测试理综化学试题河北省衡水市安平中学2020-2021学年高一下学期第一次月考化学试题河北省唐山市一中2020-2021学年高二下学期期中考试化学试题山东省日照市莒县2020-2021学年高一下学期期中考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题江西省南昌八一中学2021-2022学年高二上学期10月份月考化学试题安徽省淮北市树人高级中学2021-2022学年高二上学期第一次月考化学试题广东省普宁市第二中学2021-2022学年高二上学期9月份第一次月考化学试题福建省莆田市第二中学2021-2022学年高二上学期10月阶段检测化学试题广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题浙江省S9联盟2021-2022学年高二上学期期中联考化学试题浙江省金衢六校联盟2021-2022学年高二上学期期末联考化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 吉林省松原市长岭县第三中学2021-2022学年高二上学期第三次考试化学试题福建省厦门双十中学2021-2022学年高一下学期期中考试化学试题福建省厦门双十中学2021-2022学年高一下学期期中考试化学试题山东省新泰市第一中学2021-2022学年高一下学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期末考试化学试题四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题河北省藁城新冀明中学2021-2022学年高三上学期第一次月考化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题山东省滨州市博兴第二中学2022-2023学年高一下学期第二次月考化学试题广西柳州地区民族高级中学2022-2023学年高二下学期期中考试化学试题河南省洛阳市2022-2023学年高二下学期质量检测化学试题(已下线)2023年湖南卷高考真题变式题(选择题6-10)河南省洛阳市 洛宁县第一高级中学2022-2023学年高二下学期5月质量检测化学试题江苏省连云港市东海县石榴高级中学2022-2023学年高二上学期第一次学情测试化学试题广东省佛山市三水中学2022-2023学年高二上学期10月第一次统测化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
9 . 常温下,下列物质可用铁制容器盛装的是
| A.盐酸 | B.浓硫酸 | C.氯化铁溶液 | D.硫酸铜溶液 |
您最近一年使用:0次
2023-08-05更新
|
552次组卷
|
27卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题
广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题北京市丰台区2020-2021学年高一上学期期末考试化学试题北京市第四十三中学2020-2021学年高一下学期第一次月考化学试题北京市第十四中学2020-2021学年高一下学期期中测试化学试题北京市月坛中学2020-2021学年高一下学期期中考试化学试题北京市第五中学2020-2021学年高一下学期第一次阶段考试化学试题北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题北京市丰台区2021-2022学年高一上学期期末考试化学试题北京景山学校2021-2022学年高一下学期期中考试化学试题北京市第十一中学2021-2022学年高一下学期6月月考化学试题(已下线)3.1.1 铁的单质、氧化物及氢氧化物-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)北京市首师附密云中学2021-2022学年高一下学期等级考化学试题云南省昆明北大博雅实验中学2020-2021学年高一下学期第一次月考化学试题北京市海淀区2022-2023学年高一上学期期末考试化学试题北京市十一实验中学2022-2023学年高一上学期期末化学试题广西钦州市第四中学2022-2023学年高一下学期2月考试化学试题广东省佛山市顺德区罗定邦中学2022-2023学年高一下学期3月第一次月考化学试题北京市大兴区2022-2023学年高一下学期期中考试化学试题内蒙古通辽市重点学校2022-2023学年高一下学期3月质量检测化学试题北京市房山区2022-2023学年高一上学期期末考试化学试题(已下线)专题06 铁、铝及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)(已下线)5.1.2硫酸-随堂练习(已下线)5.1.2 硫酸湖南省怀化市第一中学2023-2024学年高一下学期入学考试 化学试题山东省中央民族大学附中青岛学校2023-2024学年高一上学期第二次阶段性检测化学试题北京市第二十二中学2023-2024学年高一下学期阶段测试化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
10 . 常温下,下列各离子组在指定溶液中能大量存在的是
A.无色溶液: 、 、 、 、 | B. 的溶液: 的溶液: 、 、 、 、 |
C.使石蕊变红的溶液: 、 、 、 、 | D. 的溶液中: 的溶液中: 、 、 、 、 |
您最近一年使用:0次
2023-07-01更新
|
199次组卷
|
3卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题



