名校
解题方法
1 . 化合物 XY3Z3M2E12是良好的电和热绝缘体,组成元素原子序数均小于20,且在前四个周期均有分布。仅X和M同族,电负性: ;Y和Z同周期,Y的基态原子价层电子排布式为
;Y和Z同周期,Y的基态原子价层电子排布式为 ,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
 ;Y和Z同周期,Y的基态原子价层电子排布式为
;Y和Z同周期,Y的基态原子价层电子排布式为 ,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是
,Z的基态原子价层的s和p轨道电子数相同;E在地壳中含量最多。下列说法正确的是A.原子半径: | B.同周期元素中比E第一电离能大的有2种 |
C.熔点: | D. 中的E的杂化方式为 中的E的杂化方式为 |
您最近一年使用:0次
2024-06-06更新
|
100次组卷
|
2卷引用:2024届广西壮族自治区贵港市高三下学期模拟预测化学试题
名校
解题方法
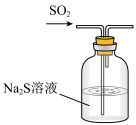
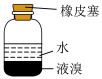
2 . 下列装置能达到实验目的的是
|
|
|
|
| A.熔化Na2CO3 | B.验证SO2氧化性 | C.实验室制CO2 | D.实验室保存液溴 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-05更新
|
387次组卷
|
4卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
广西壮族自治区贵港市2024届高三下学期收网考化学试题2024届浙江省金华市义乌市高三下学期三模化学试题(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期阶段考试(二)化学试题
3 . 制备 (S呈+2价)的化学方程式为
(S呈+2价)的化学方程式为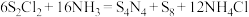 。下列说法正确的是
。下列说法正确的是
 (S呈+2价)的化学方程式为
(S呈+2价)的化学方程式为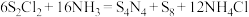 。下列说法正确的是
。下列说法正确的是A.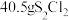 参与反应,转移电子的数目为 参与反应,转移电子的数目为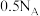 |
B.25℃、101kPa条件下,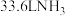 的分子数为 的分子数为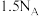 |
C.由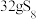 ( (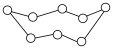 )与 )与 ( ( )组成的混合物中所含共价键的数目为 )组成的混合物中所含共价键的数目为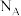 |
D.常温下,1LpH为5的 溶液中,由水电离出的 溶液中,由水电离出的 数目为 数目为 |
您最近一年使用:0次
2024-06-04更新
|
214次组卷
|
3卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
解题方法
4 . 环己烯( )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:


回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C |  |
键能/(kJ | 436 | 413 | 348 | 615 |
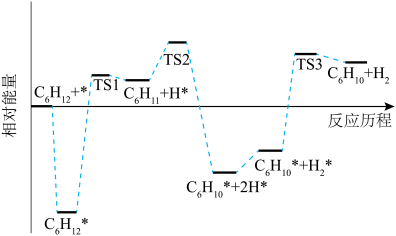
①
 的焓变小于零的原是
的焓变小于零的原是②
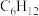 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③环己烷脱氢制备环己烯的副产物可能有
④在恒容密闭容器中充入一定量的环己烷,其初始压强为p
 ,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ= ,Kθ=
,Kθ= ,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为
 的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为 
您最近一年使用:0次
2024-06-04更新
|
122次组卷
|
4卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
名校
解题方法
5 . 我国学者用氮气为氮源制备物质甲的过程如下:
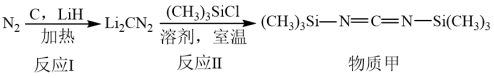
A. 的电子式: 的电子式: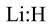 | B.基态 原子的价层电子排布图: 原子的价层电子排布图: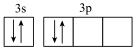 |
C. 中 中 原子的杂化方式: 原子的杂化方式: | D. 的球棍模型: 的球棍模型: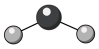 |
您最近一年使用:0次
2024-06-04更新
|
296次组卷
|
4卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
广西壮族自治区贵港市2024届高三下学期收网考化学试题山东省济南市2024届高三下学期高考针对性训练(5月)化学试题(已下线)江苏省南京市第十三中学2024届高三下学期适应性考试化学试题2024届浙江省金华市金华第一中学高三下学期模拟预测化学试题
名校
6 . EDTA(乙二胺四乙酸)是一种重要的络合剂,其结构简式为 (可简写为
(可简写为 )。某实验小组以一氯乙酸(
)。某实验小组以一氯乙酸( )和乙二胺(
)和乙二胺( )等为原料合成EDTA并测定饮用水的硬度。步骤如下:
)等为原料合成EDTA并测定饮用水的硬度。步骤如下:
 溶液至不再产生气泡为止。
溶液至不再产生气泡为止。步骤Ⅱ:向三颈烧瓶中继续加入15.60g乙二胺,摇匀,放置片刻,加入
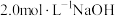 溶液90mL,加水至总体积为400mL左右,装上空气冷却回流装置,于50℃水浴上保温2h,再于沸水浴上保温回流4h。
溶液90mL,加水至总体积为400mL左右,装上空气冷却回流装置,于50℃水浴上保温2h,再于沸水浴上保温回流4h。步骤Ⅲ:取下三颈烧瓶,将混合物冷却后倒入烧杯中,加入活性炭,搅拌、过滤。
步骤Ⅳ:用浓盐酸调节pH至1.2,有白色沉淀生成,抽滤得EDTA粗品。
请回答下列问题:
(1)三颈烧瓶最适宜的规格为
(2)写出步骤Ⅰ中反应的化学方程式:
(3)步骤Ⅱ中需要配制
 溶液,下列操作中正确的是
溶液,下列操作中正确的是操作 |
|
|
|
|
选项 | a | b | c | d |
(4)使用活性炭的作用是脱色,一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是
(5)步骤Ⅳ中若选用试纸控制pH,应选用
(6)用
 溶液测定饮用水的总硬度。取饮用水样品250mL,加入掩蔽剂排除干扰、调节pH等预处理后,用
溶液测定饮用水的总硬度。取饮用水样品250mL,加入掩蔽剂排除干扰、调节pH等预处理后,用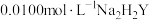 标准溶液进行测定。测定中涉及的反应有:
标准溶液进行测定。测定中涉及的反应有: (蓝色)
(蓝色) (酒红色)
(酒红色)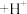 、
、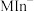 (酒红色)
(酒红色) (蓝色)
(蓝色)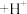 、
、 [
[ 代表
代表 、
、 ;铬黑
;铬黑 为指示剂]。
为指示剂]。①确认达到滴定终点的标志是
②平行实验三次,滴定终点时共消耗
 溶液的平均值为20.00mL,则该饮用水的硬度=
溶液的平均值为20.00mL,则该饮用水的硬度= 和
和 都看作
都看作 ,并将其折算成CaO的质量,通常把1L水中含有10mgCaO称为1度)。
,并将其折算成CaO的质量,通常把1L水中含有10mgCaO称为1度)。
您最近一年使用:0次
2024-06-02更新
|
158次组卷
|
3卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
解题方法
7 . 氟化工被称为“黄金产业”,在国民经济和社会发展中占有重要地位。我国某公司利用萤石(主要成分为 ,及少量
,及少量 、
、 等)制备无水氟化铝的主要工艺流程如下所示。
等)制备无水氟化铝的主要工艺流程如下所示。 的熔点
的熔点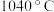 ,沸点
,沸点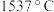 ;
;
③常温下, 。
。
请回答下列问题:
(1)在进入回转窑前,需要将萤石粉碎,其目的是_______ 。
(2)“回转窑反应”的温度控制在 之间,写出在回转窑获得
之间,写出在回转窑获得 的化学方程式:
的化学方程式:_______ 。
(3)在回转窑中的炉渣里还含有 ,将该物质在
,将该物质在 热分解,可获得两种气体(其中一种为
热分解,可获得两种气体(其中一种为 ),用多元醇选择性吸收产生的
),用多元醇选择性吸收产生的 气体,经过一系列工艺得到高纯
气体,经过一系列工艺得到高纯 。则多元醇能从两种气体中选择性吸收
。则多元醇能从两种气体中选择性吸收 的原理是
的原理是_______ 。
(4)经冷凝、精馏、脱气后的 与
与 在流化床、多级气流床中,在
在流化床、多级气流床中,在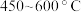 条件下进行一系列反应,由
条件下进行一系列反应,由 和
和 制备无水
制备无水 的反应的
的反应的 _______(填标号)。
_______(填标号)。
(5)常温下,向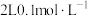 的
的 溶液中加入
溶液中加入 固体充分反应后可得
固体充分反应后可得 ,测得溶液中
,测得溶液中 的浓度为
的浓度为 ,则加入的
,则加入的 固体的物质的量为
固体的物质的量为_______ 。
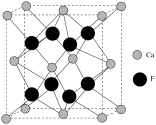
(6)已知萤石 立方晶胞参数
立方晶胞参数 ,结构如图所示,该
,结构如图所示,该 的晶体密度为
的晶体密度为_______  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
 ,及少量
,及少量 、
、 等)制备无水氟化铝的主要工艺流程如下所示。
等)制备无水氟化铝的主要工艺流程如下所示。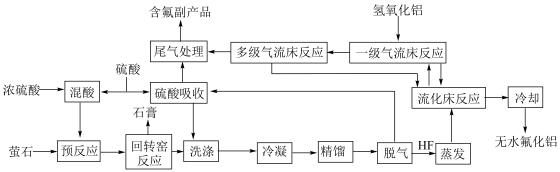
 的熔点
的熔点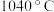 ,沸点
,沸点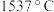 ;
;③常温下,
 。
。请回答下列问题:
(1)在进入回转窑前,需要将萤石粉碎,其目的是
(2)“回转窑反应”的温度控制在
 之间,写出在回转窑获得
之间,写出在回转窑获得 的化学方程式:
的化学方程式:(3)在回转窑中的炉渣里还含有
 ,将该物质在
,将该物质在 热分解,可获得两种气体(其中一种为
热分解,可获得两种气体(其中一种为 ),用多元醇选择性吸收产生的
),用多元醇选择性吸收产生的 气体,经过一系列工艺得到高纯
气体,经过一系列工艺得到高纯 。则多元醇能从两种气体中选择性吸收
。则多元醇能从两种气体中选择性吸收 的原理是
的原理是(4)经冷凝、精馏、脱气后的
 与
与 在流化床、多级气流床中,在
在流化床、多级气流床中,在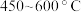 条件下进行一系列反应,由
条件下进行一系列反应,由 和
和 制备无水
制备无水 的反应的
的反应的 _______(填标号)。
_______(填标号)。| A.大于0 | B.小于0 | C.等于0 | D.无法确定 |
(5)常温下,向
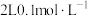 的
的 溶液中加入
溶液中加入 固体充分反应后可得
固体充分反应后可得 ,测得溶液中
,测得溶液中 的浓度为
的浓度为 ,则加入的
,则加入的 固体的物质的量为
固体的物质的量为(6)已知萤石
 立方晶胞参数
立方晶胞参数 ,结构如图所示,该
,结构如图所示,该 的晶体密度为
的晶体密度为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-06-02更新
|
86次组卷
|
2卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
8 . 常温下,分别向MnCl2、ZnCl2、CH3COOH溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-,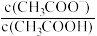 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
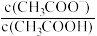 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是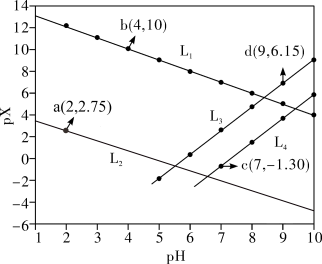
A.图中L2代表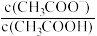 ,L3代表Mn2+ ,L3代表Mn2+ |
| B.室温下,Ksp[Zn(OH)2]的数量级为10-13 |
C.同时产生两种沉淀时,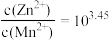 |
D.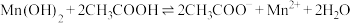 的平衡常数K=105.8 的平衡常数K=105.8 |
您最近一年使用:0次
2024-06-02更新
|
118次组卷
|
4卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
解题方法
9 . 铜及其重要化合物在生产中有着重要的应用。辉铜矿(主要成分Cu2S)可以用于制铜,制得的粗铜通过电解法进行精炼。Cu2S与浓硝酸反应可得Cu(NO3)2。Cu在O2条件下能与氨水反应生成[Cu(NH3)4]2+。向稀硫酸中加入Cu2O,溶液变蓝色并有紫红色固体产生。2022年诺贝尔化学奖授予了点击化学领域的三位科学家。一价铜催化的叠氮化物-炔烃环加成反应可谓点击化学中的第一个经典之作,催化剂CuCl是白色难溶于水的化合物,溶于较浓盐酸时生成H[CuCl2] (强酸)。
上述叙述过程涉及的离子方程式,不正确的是
上述叙述过程涉及的离子方程式,不正确的是
A.Cu2S与浓硝酸反应: |
| B.Cu2O溶于稀硫酸:Cu2O+2H+=Cu+Cu2++H2O |
C.Cu在O2存在下与氨水反应: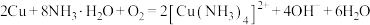 |
| D.CuCl溶于较浓盐酸:CuCl+Cl-=[CuCl2]- |
您最近一年使用:0次
2024-06-02更新
|
132次组卷
|
2卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
名校
解题方法
10 . 二氧化氯的制备及由二氧化氯制备一种重要的含氯消毒剂—亚氯酸钠(NaClO2)的工艺流程如图,下列说法正确的是

| A.“滤渣”的成分为MgCO3、CaCO3 | B.两处HCl的作用相同 |
| C.H2O2可以用KMnO4代替 | D.理论上,产生气体A、B的物质的量之比为1∶1 |
您最近一年使用:0次
2024-06-02更新
|
235次组卷
|
3卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题