1 . 将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。回答下列问题:
(1)原混合物中Na2CO3为___________ g。
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
___________
(1)原混合物中Na2CO3为
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
| V的取值范围 | n=f(V) |
您最近一年使用:0次
2 . 在标准状况下,将336LHCl气体溶解于1L水中,所得盐酸溶液的密度为1.18g/cm3.试计算这种盐酸溶液中溶质的物质的量浓度为___________ 。
您最近一年使用:0次
名校
3 . 硝酸与金属的反应
①先将5.6克铁粉与200mL一定浓度的稀硝酸混合使其充分反应,固体完全溶解,并收集到气体VL(已折算为标准状况);
②往反应后的溶液中加入一定量铜粉,铜粉恰好完全溶解,且溶解过程中无气泡产生;
③继续往溶液中加入足量NaOH溶液并过滤,将滤渣充分加热后得共到12g固体X.
回答下列问题:
(1)①中产生的气体为______ ,其体积为______ (标况下),写出产生该气体的化学方程式______ 。
(2)铜粉的质量为______ 写出铜粉溶解的离子方程式______ 。
(3)固体X中主要成分的物质的量之比为______ 。
①先将5.6克铁粉与200mL一定浓度的稀硝酸混合使其充分反应,固体完全溶解,并收集到气体VL(已折算为标准状况);
②往反应后的溶液中加入一定量铜粉,铜粉恰好完全溶解,且溶解过程中无气泡产生;
③继续往溶液中加入足量NaOH溶液并过滤,将滤渣充分加热后得共到12g固体X.
回答下列问题:
(1)①中产生的气体为
(2)铜粉的质量为
(3)固体X中主要成分的物质的量之比为
您最近一年使用:0次
4 . 将10.6gNa2CO3粉末投入500mL一定浓度的硫酸溶液中,恰好完全反应。求:
(1)标准状况下收集到CO2气体体积为___________ 。
(2)硫酸溶液的物质的量浓度为___________ 。
(1)标准状况下收集到CO2气体体积为
(2)硫酸溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
5 . 填空
(1)0.3molD2O中所含中子数与_____ 克H2O分子中所含电子数相等。
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_____ ;A的相对原子质量是_____ 。
(3)在无土栽培中,配制1L内含0.5mol 、0.64molCl-、0.56molK+、
、0.64molCl-、0.56molK+、_____ mol 的某中性营养液,若用KCl、NH4Cl、
的某中性营养液,若用KCl、NH4Cl、_____ 配制,则需这三种固体的物质的量分别为0.56mol、0.08mol、_____ mol。
(4)现有一定条件下CO2和H2O的混合气体37.5g,通过足量的Na2O2固体后,剩余的气体在标准状况的体积为11.2L,则:混合气体中CO2的物质的量为_____ mol,混合气体中H2O的质量为_____ g。
(5)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少_____ 。
(1)0.3molD2O中所含中子数与
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是
(3)在无土栽培中,配制1L内含0.5mol
 、0.64molCl-、0.56molK+、
、0.64molCl-、0.56molK+、 的某中性营养液,若用KCl、NH4Cl、
的某中性营养液,若用KCl、NH4Cl、(4)现有一定条件下CO2和H2O的混合气体37.5g,通过足量的Na2O2固体后,剩余的气体在标准状况的体积为11.2L,则:混合气体中CO2的物质的量为
(5)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少
您最近一年使用:0次
名校
6 . 电解饱和食盐水的化学反应方程式为 ,现电解消耗
,现电解消耗 的质量为
的质量为 ,完全反应后,测得烧杯中剩余溶液的质量是
,完全反应后,测得烧杯中剩余溶液的质量是 ,请计算:
,请计算:
(1)求消耗的 的物质的量
的物质的量_______ 。
(2)求生成的 在标准状况下的体积
在标准状况下的体积_______ 。
(3)求生成的 的质量
的质量_______ 。
(4)反应后所得 溶液的溶质质量分数
溶液的溶质质量分数_______ 。
 ,现电解消耗
,现电解消耗 的质量为
的质量为 ,完全反应后,测得烧杯中剩余溶液的质量是
,完全反应后,测得烧杯中剩余溶液的质量是 ,请计算:
,请计算:(1)求消耗的
 的物质的量
的物质的量(2)求生成的
 在标准状况下的体积
在标准状况下的体积(3)求生成的
 的质量
的质量(4)反应后所得
 溶液的溶质质量分数
溶液的溶质质量分数
您最近一年使用:0次
解题方法
7 . I.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

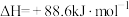
则M、N相比,较稳定的是___________ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,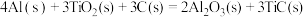
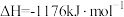 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(3) 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①
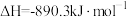 ;
;
②
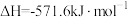 ;
;
③
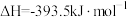 ;
;
已知 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比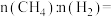 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为___________ kJ; 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
___________  。
。
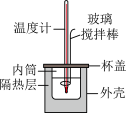
II. 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用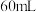
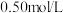 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”)。
(5)下列说法正确的是___________(填字母)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

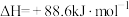
则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
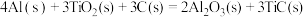
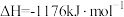 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)
 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为①

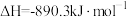 ;
;②

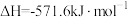 ;
;③

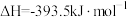 ;
;已知
 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比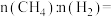 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
 。
。II.
 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用
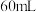
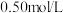 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热(5)下列说法正确的是___________(填字母)。
| A.玻璃搅拌棒可用铜丝搅拌棒替代 |
| B.向内筒中加入稀碱时,应当缓慢而匀速地加入 |
| C.实验中如果用相同体积、相同浓度的醋酸代替盐酸,测得的中和热数值将偏小 |
| D.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差 |
您最近一年使用:0次
名校
解题方法
8 . 研究化学反应中的能量变化对生产、生活有重要的意义。
(1)甲烷是一种高效清洁的新能源, 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为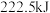 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)已知:


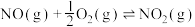


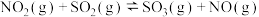


则
___________ (填含 、
、 的表达式),
的表达式),
___________ (填含 、
、 的表达式)。
的表达式)。
(3)已知: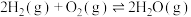
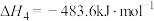 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:
①合成氨反应 的活化能
的活化能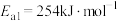 ,则氨分解反应
,则氨分解反应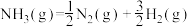 的活化能
的活化能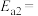
___________  。
。
②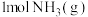 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出___________ kJ的热量;又已知
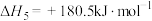 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为___________ 。
(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

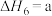
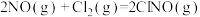
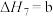
则反应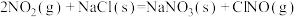 的
的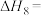
___________ (用含a、b的表达式表示)。
(1)甲烷是一种高效清洁的新能源,
 完全燃烧生成液态水时放出的热量为
完全燃烧生成液态水时放出的热量为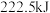 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)已知:



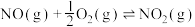


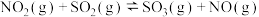


则

 、
、 的表达式),
的表达式),
 、
、 的表达式)。
的表达式)。(3)已知:
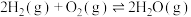
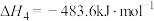 。查阅文献资料得部分化学键的键能如表所示:
。查阅文献资料得部分化学键的键能如表所示:| 化学键 | H—H |  | N—H |
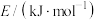 | 436 | 946 | 391 |
 的活化能
的活化能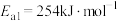 ,则氨分解反应
,则氨分解反应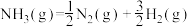 的活化能
的活化能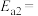
 。
。②
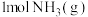 完全燃烧生成
完全燃烧生成 和水蒸气时放出
和水蒸气时放出
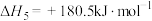 ,则氨催化氧化的热化学方程式为
,则氨催化氧化的热化学方程式为(4)研究氮氧化物与大气中悬浮的海盐粒子的相互作用时,涉及反应:

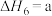
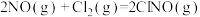
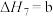
则反应
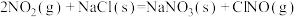 的
的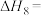
您最近一年使用:0次
2023-11-13更新
|
211次组卷
|
2卷引用:福建省泉州市2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 某温度下,在容积为2 L的密闭容器中进行如下反应:
A(g)+2B(g) 3C(g)+nD(g),开始时A为4 mol,B为6 mol。5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L−1·min−1。已知该温度下,反应的平衡常数K=1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol。5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L−1·min−1。已知该温度下,反应的平衡常数K=1。试回答下列问题:
(1)5 min时B的物质的量浓度为_______________ 。
(2)5 min内用A表示的化学反应速率v(A)为_______________ 。
(3)化学方程式中n为_______________ 。
(4)5 min时该反应是否达到平衡?请计算说明。_______________
A(g)+2B(g)
 3C(g)+nD(g),开始时A为4 mol,B为6 mol。5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L−1·min−1。已知该温度下,反应的平衡常数K=1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol。5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L−1·min−1。已知该温度下,反应的平衡常数K=1。试回答下列问题:(1)5 min时B的物质的量浓度为
(2)5 min内用A表示的化学反应速率v(A)为
(3)化学方程式中n为
(4)5 min时该反应是否达到平衡?请计算说明。
您最近一年使用:0次
名校
10 . 完成下列问题
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.0 mL。大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应: 3A(g)+B(g) xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(2)达到平衡时B的转化率为___________ 。
(3)x的值为___________ 。
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.0 mL。大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度/℃ | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响 |
| ② | 25 | 粗颗粒 | (Ⅱ)实验①和③探究温度对反应速率的影响; | |
| ③ | 粗颗粒 | 2.00 | (Ⅲ)实验①和④探究 | |
| ④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应: 3A(g)+B(g)
 xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5s后反应达到平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:(2)达到平衡时B的转化率为
(3)x的值为
您最近一年使用:0次



