名校
解题方法
1 . 氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有 |
B.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明 的氧化性强于I2 的氧化性强于I2 |
C.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有 |
D.新制氯水滴到 溶液中,有气体产生,说明氯水中含有 溶液中,有气体产生,说明氯水中含有 |
您最近一年使用:0次
2020-11-21更新
|
166次组卷
|
4卷引用:山西省运城市景胜中学2020-2021学年高一上学期期中化学试题
名校
解题方法
2 . 下列有关分散系说法正确的是
| A.从外观上无法区分FeCl3溶液和Fe(OH)3胶体 |
| B.丁达尔效应是胶体和溶液的本质区别 |
| C.将碳酸钙经过特殊加工制成纳米碳酸钙,化学性质没有明显变化 |
| D.Fe(OH)3胶体电泳的实验中,阴极附近颜色加深,阳极附近颜色变浅,证明Fe(OH)3胶体带正电 |
您最近一年使用:0次
2020-11-21更新
|
717次组卷
|
8卷引用:河北省衡水中学2021届高三上学期期中考试化学 试题
河北省衡水中学2021届高三上学期期中考试化学 试题(已下线)2021年秋季高三化学开学摸底考试卷02(山东专用)四川省眉山市仁寿县龙正中学、清水中学2021-2022学年高一上学期期中联考化学试题上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题新疆生产建设兵团第十师北屯高级中学2021-2022学年高一上学期9月月考化学试题辽宁省锦州市黑山县黑山中学2022-2023学年高三上学期9月月考化学试题(已下线)专题01 物质的组成与分类 传统文化-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)河北省唐山市开滦第一中学2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
3 . 富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如图:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
(1)上述流程中能加快反应速率的措施有__ 、__ 等。
(2)酸浸时发生反应:2MgO·SiO2+2H2SO4=2MgSO4+SiO2+2H2O,2MgO·B2O3+2H2SO4+H2O=2H3BO3+2MgSO4。
①酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:__ 、__ 。
②已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3+OH-=B(OH) 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是___ (填序号)。
a.硼酸是一元酸
b.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c.硼酸的电离方程式可表示为:H3BO3+H2O B(OH)
B(OH) +H+
+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,__ (填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子:用MgO调节溶液的pH至__ 以上,使杂质离子转化为__ (填化学式)沉淀,过滤。

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
| Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
| 完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(2)酸浸时发生反应:2MgO·SiO2+2H2SO4=2MgSO4+SiO2+2H2O,2MgO·B2O3+2H2SO4+H2O=2H3BO3+2MgSO4。
①酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:
②已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3+OH-=B(OH)
 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是a.硼酸是一元酸
b.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c.硼酸的电离方程式可表示为:H3BO3+H2O
 B(OH)
B(OH) +H+
+H+(3)检验褐色浸出液中的杂质离子:取少量浸出液,
(4)除去浸出液中的杂质离子:用MgO调节溶液的pH至
您最近一年使用:0次
2020-12-25更新
|
176次组卷
|
2卷引用:福建省福州市福清西山学校高中部2021届高三12月月考化学试题
名校
解题方法
4 . 某小组设计如图实验验证卤素单质氧化性的强弱。下列说法不正确的是( )
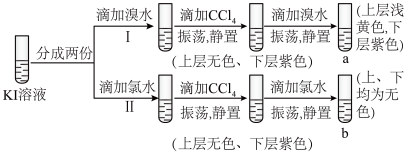

| A.CCl4起到萃取、富集I2的作用 |
| B.Ⅰ中发生反应的离子方程式为Br2+2I‒=I2+2Br‒ |
| C.b中下层变无色,因为I2被氯水氧化 |
| D.依据该实验中的现象,无法证明Cl2的氧化性比Br2强 |
您最近一年使用:0次
名校
5 . 保险粉Na2S2O4大量用于印染业,并用来漂白纸张、纸浆和陶土等。某化学兴趣小组同学用甲酸法制取保险粉的装置如图所示(加持装置略去)。
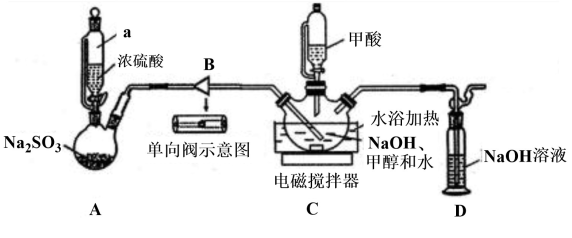
已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是______ ;装置B的作用是______ 。
(2)装置C中甲醇不参加反应,甲醇的作用是______ ;生成Na2S2O4的离子方程式为______ 。
(3)下列有关该实验的说法正确的是______ (填序号)。
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是______ ,产品Na2S2O4 (M=174g·mol-1)的质量分数为 ______ % (保留一位小数)。
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______ 。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、KMnO4溶液)

已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是
(2)装置C中甲醇不参加反应,甲醇的作用是
(3)下列有关该实验的说法正确的是
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是
您最近一年使用:0次
2020-12-21更新
|
1187次组卷
|
6卷引用:四川省成都市第七中学2021届高三一诊模拟考试理综化学试题
四川省成都市第七中学2021届高三一诊模拟考试理综化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练江西省南昌市第二中学2021-2022学年高三上学期第一次检测理综化学试题辽宁省沈阳市第一二〇中学2021-2022学年高三上学期第四次质量监测化学试题
6 . 化学物质丰富多彩,化学反应千变万化,而常见物质之间的反应往往“隐藏着某些反应机理”。学校化学兴趣小组对过氧化钠参与的某些反应进行了初步探究。
(I)该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
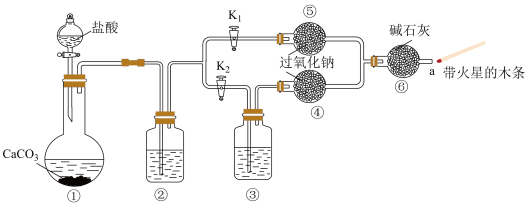
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的离子方程式是_____________
(2)装置②③中的试剂分别是____________ 、____________
(3)本实验预期现象是__________
(4)有同学提出质疑,认为上述实验即使观察到木条复燃,也不能证明有水存在时,是过氧化钠与二氧化碳发生了化学反应,其理由是____________ 。
(5)本小组还进一步探究了Na2O2与H2O的反应,实验如下:
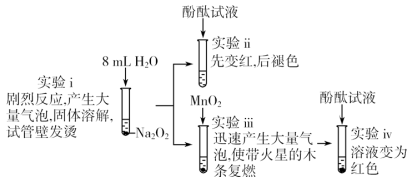
下列有关说法不正确的是____________
A 实验i中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
B 实验iii中MnO2做H2O2分解反应的催化剂
C 本实验可以说明Na2O2与H2O反应有H2O2生成
D 本实验可以说明使酚酞试液褪色的是O2
(II)Na2O2具有强氧化性,H2具有还原性,该小组成员根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该小组设计并进行如图实验。
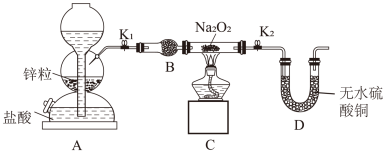
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(6)B装置中所盛放的试剂是________ ,其作用是__________ 。
(7)步骤3中的“必要操作”为打开K1、K2,________ (请按正确的顺序填入下列步骤的字母)。
A 加热至Na2O2逐渐熔化,反应一段时间
B 用小试管收集气体并检验其纯度
C 关闭K1
D 停止加热,充分冷却
(8)由上述实验可推出Na2O2与H2反应的化学方程式为____________ 。
(I)该小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。

步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的离子方程式是
(2)装置②③中的试剂分别是
(3)本实验预期现象是
(4)有同学提出质疑,认为上述实验即使观察到木条复燃,也不能证明有水存在时,是过氧化钠与二氧化碳发生了化学反应,其理由是
(5)本小组还进一步探究了Na2O2与H2O的反应,实验如下:

下列有关说法不正确的是
A 实验i中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
B 实验iii中MnO2做H2O2分解反应的催化剂
C 本实验可以说明Na2O2与H2O反应有H2O2生成
D 本实验可以说明使酚酞试液褪色的是O2
(II)Na2O2具有强氧化性,H2具有还原性,该小组成员根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该小组设计并进行如图实验。

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝。
(6)B装置中所盛放的试剂是
(7)步骤3中的“必要操作”为打开K1、K2,
A 加热至Na2O2逐渐熔化,反应一段时间
B 用小试管收集气体并检验其纯度
C 关闭K1
D 停止加热,充分冷却
(8)由上述实验可推出Na2O2与H2反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 下图是元素周期表的一部分。按要求填写下列空白:
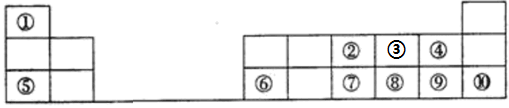
(1)元素⑦在周期表中的位置可表示为______ 。
(2)④、⑤、⑥、⑧、⑨的简单离子半径的大小顺序为______ (填离子符号)。
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是______ (用化学式表示)。
(5)将②的最高价氧化物通入 溶液,反应的化学方程式为
溶液,反应的化学方程式为______ ,该反应中说明酸性______ >______ (填化学式),能否由此推知②的非金属性大于 ?
?______ (填“能”或“否”)
(6)⑤的最高价氧化物对应的水化物的电子式为______ ;⑧的氢化物的结构式为______
(7)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为______ 。
(8)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置可表示为
(2)④、⑤、⑥、⑧、⑨的简单离子半径的大小顺序为
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)将②的最高价氧化物通入
 溶液,反应的化学方程式为
溶液,反应的化学方程式为 ?
?(6)⑤的最高价氧化物对应的水化物的电子式为
(7)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为
(8)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2021-03-07更新
|
228次组卷
|
2卷引用:江苏省苏州市苏州大学附属中学2020-2021学年高一上学期月考化学试卷2
19-20高一·浙江·阶段练习
解题方法
8 . 下列有关钠及其化合物说法正确的是
| A.金属钠着火时,可用水来灭火 |
| B.用加热法除去NaHCO3固体中混有的Na2CO3 |
| C.灼烧白色粉末,火焰呈黄色,证明原粉末为钠盐 |
| D.Na、Na2O、Na2O2、NaOH久置于空气中,最终都将变为Na2CO3 |
您最近一年使用:0次
解题方法
9 . 下列说法可以证明反应N2(g)+3H2(g)=2NH3(g)已达到平衡状态的是
A.1个N N键断裂的同时,有3个H—H键形成 N键断裂的同时,有3个H—H键形成 |
B.1个N N键断裂的同时,有3个H—H键断裂 N键断裂的同时,有3个H—H键断裂 |
| C.N2、H2、NH3的反应速率之比为1∶3∶2 |
| D.3个H—H键断裂的同时,有6个H—N键形成 |
您最近一年使用:0次
解题方法
10 . 实验室用图示装置制取干燥的氨气:
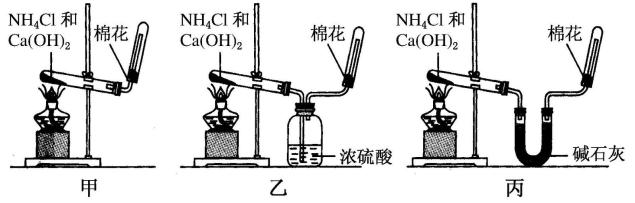
(1)工业制备氨气的化学方程式是___________ 。
(2)若想制得干燥的氨气,应选择装置___________ (填“甲”“乙”或“丙”),不能用乙装置干燥氨气的原因___________ (用化学方程式表示)。
(3)检验试管C中氨气收集满的方法是___________ 。
(4)试管口放置棉花的作用是___________ 。
(5)某同学设计了如图装置收集氨气,下列说法不正确的是___________ (填字母)。

A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
(6)如图是氮元素的几种化合价与物质类别的对应关系:

回答下列问题:
①实验室制取物质B的化学方程式为___________ 。
②NO2与水反应生成物质A的化学方程式为___________

(1)工业制备氨气的化学方程式是
(2)若想制得干燥的氨气,应选择装置
(3)检验试管C中氨气收集满的方法是
(4)试管口放置棉花的作用是
(5)某同学设计了如图装置收集氨气,下列说法不正确的是

A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
(6)如图是氮元素的几种化合价与物质类别的对应关系:

回答下列问题:
①实验室制取物质B的化学方程式为
②NO2与水反应生成物质A的化学方程式为
您最近一年使用:0次



