2024·甘肃·模拟预测
1 .  为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A.常温常压下, 金刚石含有4NA个共价键 金刚石含有4NA个共价键 |
B. 的乙酸和盐酸混合溶液含0.1NA个 的乙酸和盐酸混合溶液含0.1NA个 |
C.标准状态下,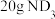 含有的质子数为10NA 含有的质子数为10NA |
D.电解水生成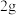 氢气,外电路通过1NA个电子 氢气,外电路通过1NA个电子 |
您最近一年使用:0次
2024·江西·模拟预测
名校
2 . 火箭表面耐高温涂层的制备反应为 。阿伏伽德罗常数的值为
。阿伏伽德罗常数的值为 ,下列说法正确的是
,下列说法正确的是
 。阿伏伽德罗常数的值为
。阿伏伽德罗常数的值为 ,下列说法正确的是
,下列说法正确的是A. 中共价键的数目为 中共价键的数目为 |
B. 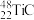 中含有的中子数为 中含有的中子数为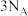 |
C.  固体含有 固体含有 的数目为 的数目为 |
D.消耗 时,该反应中转移的电子数为 时,该反应中转移的电子数为 |
您最近一年使用:0次
2024-01-23更新
|
1101次组卷
|
5卷引用:2024年1月“九省联考”江西卷真题完全解读与考后提升
(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题1-5(已下线)热点04 有关阿伏加德罗常数的正误判断2024年1月江西普通高等学校招生考试适应性测试化学试题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题
23-24高三上·河南驻马店·期末
名校
解题方法
3 . 碱式硫酸镁晶须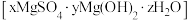 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含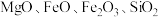 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
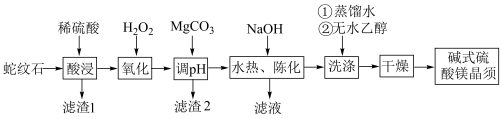
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是_______ 。
(2)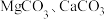 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:_______ 。
(3)洗涤步骤中用无水乙醇洗涤的目的是_______ 。
(4)氧化的目的是_______ (用离子方程式表示),为检验溶液中的离子是否完全被氧化,可使用的试剂为_______ (填化学式)。
(5)将碱式硫酸镁晶须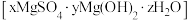 进行热重分析测定其化学式,
进行热重分析测定其化学式,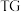 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为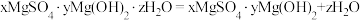 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为_______ ;第二次失重发生反应的化学方程式为_______ 。
②图2中的晶胞参数为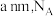 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为_______ ,该晶体的密度为_______  。
。
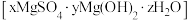 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含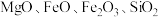 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是
(2)
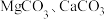 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:(3)洗涤步骤中用无水乙醇洗涤的目的是
(4)氧化的目的是
(5)将碱式硫酸镁晶须
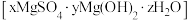 进行热重分析测定其化学式,
进行热重分析测定其化学式,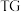 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为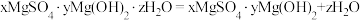 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为
②图2中的晶胞参数为
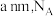 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为 。
。
您最近一年使用:0次
2024-01-22更新
|
261次组卷
|
4卷引用:T28-工业流程题
23-24高三上·河南驻马店·期末
4 . 设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A. 金属钠生成 金属钠生成 ,转移的电子数为 ,转移的电子数为 |
B.标准状况下, 中含 中含 键的数目为 键的数目为 |
C.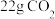 通入水中得到的溶液中含有的 通入水中得到的溶液中含有的 分子数为 分子数为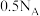 |
D.由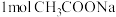 和少量 和少量 形成的中性溶液中, 形成的中性溶液中, 数目小于 数目小于 |
您最近一年使用:0次
2024-01-22更新
|
199次组卷
|
4卷引用:选择题1-5
23-24高三上·浙江杭州·阶段练习
名校
5 . 火箭推进发生反应的化学方程式为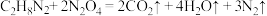 (
(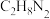 中C、N元素的化合价相等)。下列说法正确的是
中C、N元素的化合价相等)。下列说法正确的是
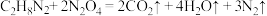 (
(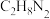 中C、N元素的化合价相等)。下列说法正确的是
中C、N元素的化合价相等)。下列说法正确的是A.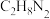 是氧化剂 是氧化剂 | B.氧化产物与还原产物物质的量之比为3∶2 |
C. 被氧化 被氧化 | D. 完全反应,有 完全反应,有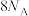 个电子转移 个电子转移 |
您最近一年使用:0次
23-24高三上·河南南阳·阶段练习
6 . 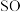 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开 1和
1和 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
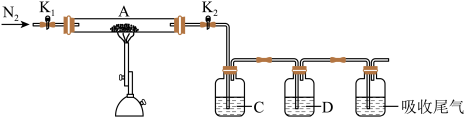
①装置C的溶液为_______ (填标号)。装置D可观察到的实验现象为_______ 。
a.品红 b.NaOH c.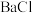 2 d.
2 d. e.浓硫酸
e.浓硫酸
②写出硫酸亚铁高温分解的化学方程式_______ 。
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性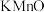 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
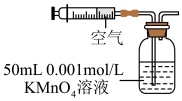
①二氧化硫和酸性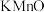 4溶液反应的离子方程式为
4溶液反应的离子方程式为_______ 。
②该空气中二氧化硫的体积分数为_______ (用含Ⅴ的代数式表示)。
(3)某化工厂用如图所示工艺流程除去燃煤产生的 2。
2。

①过程I发生的反应中,氧化剂与还原剂的物质的量之比为_______ 。
②过程Ⅱ发生反应的化学方程式为_______ 。
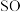 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开
 1和
1和 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
①装置C的溶液为
a.品红 b.NaOH c.
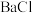 2 d.
2 d. e.浓硫酸
e.浓硫酸②写出硫酸亚铁高温分解的化学方程式
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性
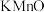 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
①二氧化硫和酸性
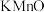 4溶液反应的离子方程式为
4溶液反应的离子方程式为②该空气中二氧化硫的体积分数为
(3)某化工厂用如图所示工艺流程除去燃煤产生的
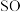 2。
2。
①过程I发生的反应中,氧化剂与还原剂的物质的量之比为
②过程Ⅱ发生反应的化学方程式为
您最近一年使用:0次
23-24高三上·浙江宁波·阶段练习
名校
解题方法
7 . Operando光谱和DFT计算明确了在负载 的
的 上
上 选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
 的
的 上
上 选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是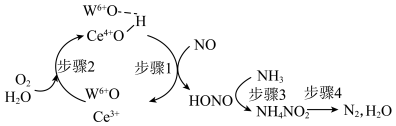
| A.步骤3、4都是氧化还原反应 |
B.步骤2中氧化剂与还原剂的物质的量之比为 |
C.每生成 理论上消耗 理论上消耗 |
D.上述过程的总反应方程式: |
您最近一年使用:0次
2024-01-12更新
|
314次组卷
|
4卷引用:压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)浙江省宁波市镇海中学2023-2024学年高三上学期首考12月模拟卷化学试题福建省宁德市福古霞三校2024届高三3月份适应性检测化学试题
23-24高三上·天津·阶段练习
名校
8 . 羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。一定条件下, 与CO能反应生成羰基硫:
与CO能反应生成羰基硫:
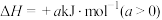 ,设
,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 与CO能反应生成羰基硫:
与CO能反应生成羰基硫:
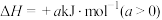 ,设
,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.1molCO与 充分反应可生成COS分子的数目为 充分反应可生成COS分子的数目为 |
B.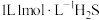 溶液中含有的 溶液中含有的 数目为 数目为 |
C.1molCOS中含有的双键数目为 |
D.每转移 个 个 ,吸收akJ能量 ,吸收akJ能量 |
您最近一年使用:0次
2023高三·全国·专题练习
9 . 利用制得的精盐配制饱和NaCl溶液,再通过下列步骤可制得纯碱:
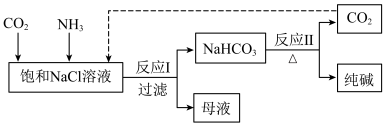
已知:反应Ⅰ为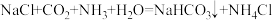 。
。
(1)反应Ⅱ的化学方程式是_______ 。
(2)制得的纯碱中含有少量NaCl。取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL ,则样品中纯碱的质量分数是
,则样品中纯碱的质量分数是_______ (精确到0.1)%。

已知:反应Ⅰ为
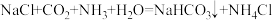 。
。(1)反应Ⅱ的化学方程式是
(2)制得的纯碱中含有少量NaCl。取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL
 ,则样品中纯碱的质量分数是
,则样品中纯碱的质量分数是
您最近一年使用:0次
23-24高三上·四川内江·阶段练习
名校
解题方法
10 . 资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和___________ 。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为___________ 。
(3)已知N2H4 被银氨溶液氧化的产物是氮气,则每生成1 mol Ag,需要消耗___________ g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4,在NaAuCl4中Au元素的化合价为___________ ,该反应的离子方程式为___________ 。
(5)阳极泥中的铜可以用FeCl3 溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)___________ (用离子方程式表示),然后加入适量的CuO调节pH=3.7,除去___________ (离子);
②根据图中数据计算可得Cu(OH)2的Ksp约为___________ 。
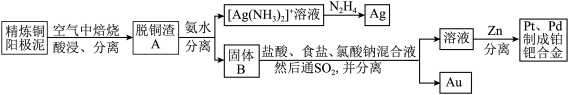
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为
(3)已知N2H4 被银氨溶液氧化的产物是氮气,则每生成1 mol Ag,需要消耗
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4,在NaAuCl4中Au元素的化合价为
(5)阳极泥中的铜可以用FeCl3 溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)
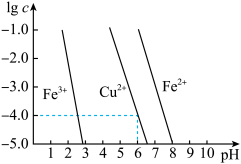
②根据图中数据计算可得Cu(OH)2的Ksp约为
您最近一年使用:0次



