解题方法
1 .  是重要的化工原料,可发生如下转化:
是重要的化工原料,可发生如下转化: ,可得到氮肥硫酸铵,写出该反应的化学方程式
,可得到氮肥硫酸铵,写出该反应的化学方程式______ 。
(2)氨气可经途径II的多步反应制得硝酸,下列有关说法正确的是______。
(3)醋酸(熔点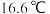 )、硝酸(熔点
)、硝酸(熔点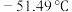 )这两种相对分子质量相近的分子熔沸点相差较大的主要原因是
)这两种相对分子质量相近的分子熔沸点相差较大的主要原因是______ 。
(4) 与
与 性质相似,写出足量
性质相似,写出足量 与稀硫酸反应所得产物的化学式
与稀硫酸反应所得产物的化学式______ 。
(5)途径 中
中 过量,用离子方程式解释途径
过量,用离子方程式解释途径 中溶液颜色变化的原因
中溶液颜色变化的原因______ 。
(6) 可与
可与 反应得到化合物
反应得到化合物 和一种无机盐,设计实验验证产物中分离出的化合物
和一种无机盐,设计实验验证产物中分离出的化合物 中含有氮元素
中含有氮元素______ 。
 是重要的化工原料,可发生如下转化:
是重要的化工原料,可发生如下转化: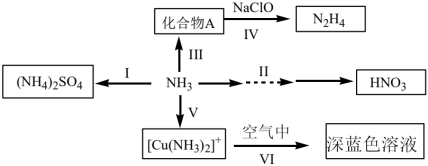
①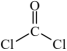
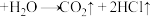 ;②
;② (无色)容易被空气氧化
(无色)容易被空气氧化
 ,可得到氮肥硫酸铵,写出该反应的化学方程式
,可得到氮肥硫酸铵,写出该反应的化学方程式(2)氨气可经途径II的多步反应制得硝酸,下列有关说法正确的是______。
A.工业生产得到的浓硝酸,常因溶解了 而略显黄色 而略显黄色 |
B.氨气先经过催化氧化得到 , , 再与水反应生成硝酸 再与水反应生成硝酸 |
C.浓硝酸与甘油在一定条件下反应生成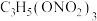 ,该反应为酯化反应 ,该反应为酯化反应 |
| D.工业上常用铁罐车或铝罐车运送浓硝酸,是因为常温下它们和浓硝酸不反应 |
(3)醋酸(熔点
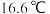 )、硝酸(熔点
)、硝酸(熔点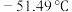 )这两种相对分子质量相近的分子熔沸点相差较大的主要原因是
)这两种相对分子质量相近的分子熔沸点相差较大的主要原因是(4)
 与
与 性质相似,写出足量
性质相似,写出足量 与稀硫酸反应所得产物的化学式
与稀硫酸反应所得产物的化学式(5)途径
 中
中 过量,用离子方程式解释途径
过量,用离子方程式解释途径 中溶液颜色变化的原因
中溶液颜色变化的原因(6)
 可与
可与 反应得到化合物
反应得到化合物 和一种无机盐,设计实验验证产物中分离出的化合物
和一种无机盐,设计实验验证产物中分离出的化合物 中含有氮元素
中含有氮元素
您最近一年使用:0次
名校
解题方法
2 . 斑铜矿(主要成分是Cu5FeS4,含少量SiO2)是自然界中最丰富的含铜矿物之一,以斑铜矿为原料可实现如下转化。
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③ 加热时易失去NH3。
加热时易失去NH3。
请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是_______ 。
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为_______ 。
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是_______ 。
(3)写出溶液D中的所有阳离子_______ 。
(4)写出反应I的离子方程式_______ 。
(5)将斑铜矿在有氧条件下用氨水浸出,可制得 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:_______ 。

②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③
 加热时易失去NH3。
加热时易失去NH3。请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是
(3)写出溶液D中的所有阳离子
(4)写出反应I的离子方程式
(5)将斑铜矿在有氧条件下用氨水浸出,可制得
 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:
您最近一年使用:0次
2024-04-18更新
|
448次组卷
|
3卷引用:浙江省宁波市2024届高三下学期二模化学试题
3 . 下列化学反应与方程式相符的是
A.氢氧化钠溶液中加入过量草酸: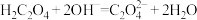 |
B.碱性条件下,氢氧化铁与次氯酸钠溶液反应制备高铁酸钠 : :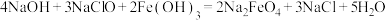 |
C.工业制取高纯硅: |
D.尿素与甲醛反应生成某线型脲醛树脂: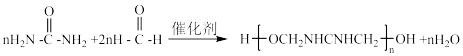 |
您最近一年使用:0次
解题方法
4 . 二氧化硫脲[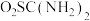 ](
](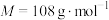 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](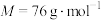 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
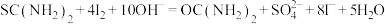
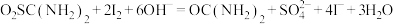

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
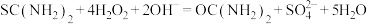


该产品中二氧化硫脲的质量分数为____________ 。
 ](
](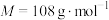 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: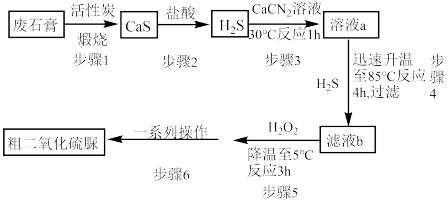

①滤液b主要成份为硫脲[
 ](
](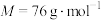 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
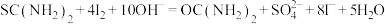
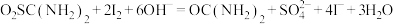

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
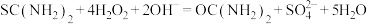


该产品中二氧化硫脲的质量分数为
您最近一年使用:0次
名校
5 . 古代青铜器的出土,体现了古代中国对人类物质文明的巨大贡献。青铜器埋藏会产生多种锈蚀产物,其中 结构致密,可以阻止内部青铜继续被腐蚀,而
结构致密,可以阻止内部青铜继续被腐蚀,而 结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:不正确 的是
 结构致密,可以阻止内部青铜继续被腐蚀,而
结构致密,可以阻止内部青铜继续被腐蚀,而 结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
A.青铜锈蚀Ⅰ过程属于电化学腐蚀,负极的电极反应方程式为: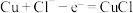 |
B.青铜锈蚀Ⅰ过程中 浓度越大,腐蚀趋势越大 浓度越大,腐蚀趋势越大 |
C.青铜锈蚀Ⅲ生成 的方程式为: 的方程式为: |
| D.青铜器修复可用碳酸钠溶液浸泡一段时间,使其保存更长久 |
您最近一年使用:0次
2024-04-15更新
|
618次组卷
|
6卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题 2024届浙江省绍兴市高三下学期第二次模拟考试 化学试题 (已下线)选择题11-16河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题湖北省襄阳四中2024届高三下学期学业水平适应性考试(一模)化学试题(已下线)专题09 电化学基础-【好题汇编】3年(2022-2024)高考1年模拟化学真题分类汇编(湖北专用)
6 . 半水煤气(含有 、
、 、
、 、
、 ,以及少量的
,以及少量的 、
、 和
和 )经提纯后可获得工业合成氨所需的
)经提纯后可获得工业合成氨所需的 和
和 混合气。过程如下:
混合气。过程如下:
 。
。
② 与
与 反应的方程式为:
反应的方程式为: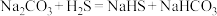 。
。
③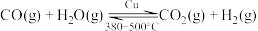
 。请回答:
。请回答:
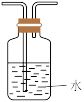
(1)半水煤气通过___________ 溶液(填化学式)可证明有 气体。
气体。
(2)在“催化转化炉”的后半段补充通入 作“冷激气”,原因是
作“冷激气”,原因是___________ 。
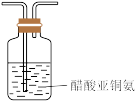
(3)已知:高压下 极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收
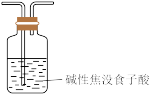
极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收 ,碱性焦没食子酸溶液(易受酸性气体影响)可吸收
,碱性焦没食子酸溶液(易受酸性气体影响)可吸收 。“精制过程”需除去混合气体中的
。“精制过程”需除去混合气体中的 、
、 、
、 和
和 ,请排序
,请排序___________ : ___________ ___________
___________ ___________
___________ ___________。
___________。
(4)通过测定“催化转化炉”进出口气体中 体积分数以确定
体积分数以确定 转化率。取标况下
转化率。取标况下 进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(
进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(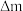 )如下:
)如下:___________
② 体积分数为
体积分数为___________ (用含 及
及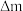 的式子表示,忽略空气影响)。
的式子表示,忽略空气影响)。
(5)下列说法正确的是___________
 、
、 、
、 、
、 ,以及少量的
,以及少量的 、
、 和
和 )经提纯后可获得工业合成氨所需的
)经提纯后可获得工业合成氨所需的 和
和 混合气。过程如下:
混合气。过程如下:

 。
。②
 与
与 反应的方程式为:
反应的方程式为: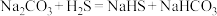 。
。③
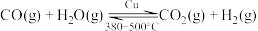
 。请回答:
。请回答:(1)半水煤气通过
 气体。
气体。(2)在“催化转化炉”的后半段补充通入
 作“冷激气”,原因是
作“冷激气”,原因是(3)已知:高压下
 极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收
极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收 ,碱性焦没食子酸溶液(易受酸性气体影响)可吸收
,碱性焦没食子酸溶液(易受酸性气体影响)可吸收 。“精制过程”需除去混合气体中的
。“精制过程”需除去混合气体中的 、
、 、
、 和
和 ,请排序
,请排序 ___________
___________ ___________
___________ ___________。
___________。
|
|
|
|
| (a) | (b) | (c) | (d) |
(4)通过测定“催化转化炉”进出口气体中
 体积分数以确定
体积分数以确定 转化率。取标况下
转化率。取标况下 进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(
进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(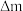 )如下:
)如下:
②
 体积分数为
体积分数为 及
及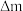 的式子表示,忽略空气影响)。
的式子表示,忽略空气影响)。(5)下列说法正确的是___________
A.“煤气发生炉”应先通 后通 后通 |
B.采用饱和 溶液吸收 溶液吸收 会造成管道堵塞 会造成管道堵塞 |
C.吸收塔内放置空心瓷环可提高 的吸收率 的吸收率 |
D.半水煤气中的 会导致 会导致 催化剂失效 催化剂失效 |
您最近一年使用:0次
2024-04-15更新
|
334次组卷
|
4卷引用:浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题
浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题湖南省衡阳县四中2024届高三下学期高考考前冲刺卷(四)化学试题(已下线)第04讲 综合实验题型探究(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
7 . 高铁酸钠 是一种高效杀菌、净水剂,用废铁屑制备高铁酸钠的流程如图所示。下列说法
是一种高效杀菌、净水剂,用废铁屑制备高铁酸钠的流程如图所示。下列说法不正确 的是
 是一种高效杀菌、净水剂,用废铁屑制备高铁酸钠的流程如图所示。下列说法
是一种高效杀菌、净水剂,用废铁屑制备高铁酸钠的流程如图所示。下列说法
| A.步骤①中加入碳酸钠溶液的作用是除去铁屑中的油污 |
B.步骤③中试剂x可以是加入过量氢氧化钠溶液的同时鼓入空气,将产生的沉淀过滤、洗涤,不需要烘干,得到 固体 固体 |
C.步骤④中涉及到的离子方程式为: |
| D.高铁酸钠加入水中,表现强氧化性,能杀死微生物和细菌,生成的氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,从而达到杀菌、净水的效果 |
您最近一年使用:0次
名校
8 . 已知: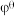 (Fe3+/Fe2+)=+0.77V,
(Fe3+/Fe2+)=+0.77V,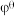 (Br2/Br-)=+1.07V,
(Br2/Br-)=+1.07V,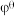 (H2O2/H2O)=+1.78V,
(H2O2/H2O)=+1.78V,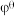 (Sn4+/Sn2+)=+0.15V,则下列各组物质在标准态下能共存的是
(Sn4+/Sn2+)=+0.15V,则下列各组物质在标准态下能共存的是
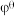 (Fe3+/Fe2+)=+0.77V,
(Fe3+/Fe2+)=+0.77V,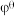 (Br2/Br-)=+1.07V,
(Br2/Br-)=+1.07V,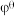 (H2O2/H2O)=+1.78V,
(H2O2/H2O)=+1.78V,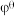 (Sn4+/Sn2+)=+0.15V,则下列各组物质在标准态下能共存的是
(Sn4+/Sn2+)=+0.15V,则下列各组物质在标准态下能共存的是| A.Fe3+,Sn2+ | B.Sn4+,Fe2+ | C. Sn2+,Br2 | D.H2O2,Fe2+ |
您最近一年使用:0次
解题方法
9 . 固态化合物CaCu2O3有如下转化:
(1)用化学式表示A的组成___________ ,写出溶液D中主要的阳离子___________ 。
(2)下列说法正确的是___________。
(3)已知高铜酸钠(NaCuO2)是一种黑色难溶于水的固体,具有强氧化性,但在中性或碱性溶液下稳定,可在NaOH溶液中用NaClO氧化Cu(OH)2制得。
①写出制备NaCuO2的离子方程式___________ 。
②制备的高铜酸钠中可能含有Cu(OH)2,设计实验证明Cu(OH)2是否存在___________ 。

(1)用化学式表示A的组成
(2)下列说法正确的是___________。
| A.反应Ⅰ中NH3体现氧化性 |
B.反应Ⅱ的现象说明稳定性: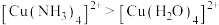 |
| C.气体混合物B的组成为N2、NH3 |
| D.固体G与水反应可以得到NH3 |
(3)已知高铜酸钠(NaCuO2)是一种黑色难溶于水的固体,具有强氧化性,但在中性或碱性溶液下稳定,可在NaOH溶液中用NaClO氧化Cu(OH)2制得。
①写出制备NaCuO2的离子方程式
②制备的高铜酸钠中可能含有Cu(OH)2,设计实验证明Cu(OH)2是否存在
您最近一年使用:0次
名校
解题方法
10 . 工业上常以天青石(主要成分为SrSO4,含少量BaSO4)为原料制取SrCl2·6H2O,生产流程如下:
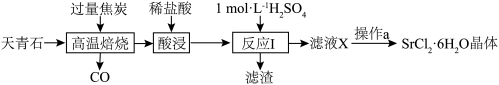
A.高温焙烧时,若0.2molSrSO4完全反应转移了1.6mol电子,该反应化学方程式为SrSO4+4C SrS+4CO↑ SrS+4CO↑ |
| B.反应Ⅰ中,应使用过量的H2SO4来提高锶元素的利用率 |
| C.为除去SrCl2·6H2O晶体表面杂质,可使用无水乙醇洗涤 |
| D.为得到无水SrCl2,可直接加热SrCl2·6H2O脱去结晶水制得 |
您最近一年使用:0次
2024-04-04更新
|
120次组卷
|
3卷引用:浙江省湖州中学2023-2024学年高二下学期第二次阶段检测化学试卷