解题方法
1 . 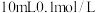 的酸性(用硫酸酸化)
的酸性(用硫酸酸化) 溶液中,加入
溶液中,加入 的
的 溶液时恰好完全反应,产生
溶液时恰好完全反应,产生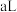 气体(该气体在标准状况下密度为
气体(该气体在标准状况下密度为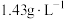 ),已知此条件下该反应生成了
),已知此条件下该反应生成了 ,试回答或计算下列问题:
,试回答或计算下列问题:
(1)该反应的离子方程式为___________ 。
(2) 的物质的量浓度为
的物质的量浓度为___________ 。
(3)若生成的气体折算为标准状况,则
___________  。
。
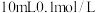 的酸性(用硫酸酸化)
的酸性(用硫酸酸化) 溶液中,加入
溶液中,加入 的
的 溶液时恰好完全反应,产生
溶液时恰好完全反应,产生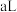 气体(该气体在标准状况下密度为
气体(该气体在标准状况下密度为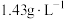 ),已知此条件下该反应生成了
),已知此条件下该反应生成了 ,试回答或计算下列问题:
,试回答或计算下列问题:(1)该反应的离子方程式为
(2)
 的物质的量浓度为
的物质的量浓度为(3)若生成的气体折算为标准状况,则

 。
。
您最近一年使用:0次
解题方法
2 . 用下列装置制备无水 ,已知固体
,已知固体 极易吸水且与水反应,请回答以下问题:
极易吸水且与水反应,请回答以下问题:

(1)装置A中盛放浓盐酸的仪器名称是___________ 。
(2)A中发生的化学反应方程式是___________ 。
(3)装置按气体从左到右排列为 ,其中
,其中 接
接 时,导管①接
时,导管①接 的
的___________ ,C装置的作用是___________ 。
(4)这套装置明显存在一个缺陷,改进的方法是___________ 。
(5) 浓溶液与浓盐酸反应可快速制备
浓溶液与浓盐酸反应可快速制备 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
 ,已知固体
,已知固体 极易吸水且与水反应,请回答以下问题:
极易吸水且与水反应,请回答以下问题:
(1)装置A中盛放浓盐酸的仪器名称是
(2)A中发生的化学反应方程式是
(3)装置按气体从左到右排列为
 ,其中
,其中 接
接 时,导管①接
时,导管①接 的
的(4)这套装置明显存在一个缺陷,改进的方法是
(5)
 浓溶液与浓盐酸反应可快速制备
浓溶液与浓盐酸反应可快速制备 ,其反应的离子方程式为
,其反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 化学与人类生活密切相关。请按要求回答下列问题:
(1)小苏打可用于治疗胃酸过多,其反应的化学方程式为_______ 。
(2)电子工业中常用氯化铁溶液刻蚀覆铜板制印刷电路板,该反应的离子方程式为_______ 。
(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)而发生氯气中毒事件,其原理为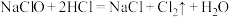 。该反应的氧化剂是
。该反应的氧化剂是_______ (填化学式);当生成的气体在标准状况下的体积为5.6L时转移的电子数为_______ 个。
(1)小苏打可用于治疗胃酸过多,其反应的化学方程式为
(2)电子工业中常用氯化铁溶液刻蚀覆铜板制印刷电路板,该反应的离子方程式为
(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)而发生氯气中毒事件,其原理为
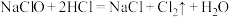 。该反应的氧化剂是
。该反应的氧化剂是
您最近一年使用:0次
名校
4 . 工业上氮氧化物( :NO和
:NO和 混合气)废气吸收利用的某流程如下:
混合气)废气吸收利用的某流程如下:
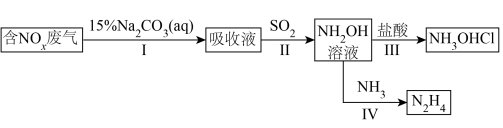
已知:氧化度 ;吸收液含有的产物有
;吸收液含有的产物有 和
和 ;
; 在碱性条件下受热分解产物之一为
在碱性条件下受热分解产物之一为 。
。
请回答:
(1)过程Ⅳ以“肼合成酶”催化 与
与 转化为肼(
转化为肼(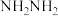 )的反应历程如下所示:
)的反应历程如下所示:
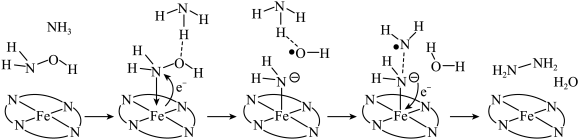
该反应历程中Fe元素的化合价___________ (填“变化”或“不变”)。若将 替换为
替换为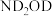 ,反应制得的肼的结构简式为
,反应制得的肼的结构简式为___________ 。
(2)写出过程Ⅰ中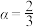 时反应的离子方程式
时反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4) 是一种理想还原剂,氧化产物对环境友好,写出
是一种理想还原剂,氧化产物对环境友好,写出 还原
还原 的化学方程式
的化学方程式___________ 。
(5)设计实验证明 中存在N元素
中存在N元素___________ 。
 :NO和
:NO和 混合气)废气吸收利用的某流程如下:
混合气)废气吸收利用的某流程如下:
已知:氧化度
 ;吸收液含有的产物有
;吸收液含有的产物有 和
和 ;
; 在碱性条件下受热分解产物之一为
在碱性条件下受热分解产物之一为 。
。请回答:
(1)过程Ⅳ以“肼合成酶”催化
 与
与 转化为肼(
转化为肼(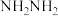 )的反应历程如下所示:
)的反应历程如下所示:
该反应历程中Fe元素的化合价
 替换为
替换为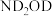 ,反应制得的肼的结构简式为
,反应制得的肼的结构简式为(2)写出过程Ⅰ中
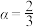 时反应的离子方程式
时反应的离子方程式(3)下列说法正确的是___________。
A.过程Ⅰ采用气、液逆流的方式可提高 的吸收效率 的吸收效率 |
B. 的键角小于 的键角小于 |
C. 可作为配体,与 可作为配体,与 等金属离子形成配合物 等金属离子形成配合物 |
D. 的水溶液显弱碱性,且 的水溶液显弱碱性,且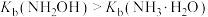 |
(4)
 是一种理想还原剂,氧化产物对环境友好,写出
是一种理想还原剂,氧化产物对环境友好,写出 还原
还原 的化学方程式
的化学方程式(5)设计实验证明
 中存在N元素
中存在N元素
您最近一年使用:0次
2023-11-15更新
|
421次组卷
|
3卷引用:浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题
浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)新疆乌鲁木齐市第六十八中学2023-2024学年高三上学期1月月考化学试题
名校
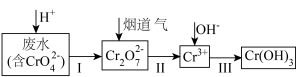
5 . 以下是工业上利用烟道气中的二氧化硫处理含铬(Ⅵ)废水的工艺流程: 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法不正确 的是
 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法A. 转化过程中,溶液颜色由黄色变为橙色 转化过程中,溶液颜色由黄色变为橙色 |
B.过程Ⅱ中 是还原剂, 是还原剂, 为还原产物 为还原产物 |
C.处理废水中的 (不考虑其它氧化剂存在),转移电子数为 (不考虑其它氧化剂存在),转移电子数为 |
D.烟道气可以用 或 或 代替 代替 |
您最近一年使用:0次
2023-11-15更新
|
1082次组卷
|
6卷引用:浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题
浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)江西省抚州市黎川县第二中学2023-2024学年高三上学期11月期中化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届辽宁省大连市高三下学期3月三校联考化学试卷
6 . 废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、SiO2.某研究小组设计如图所示工艺流程制备硫酸镍晶体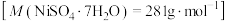 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
(1)“滤渣2”的成分是___________ (用化学式表示)。溶液中加入H2O2的目的是___________ (用离子方程式表示)。
(2)“调pH”可选用的物质___________ (填序号)。
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为___________ 。
(3)下列有关说法不正确 的是___________。
(4)测定产品的纯度。
计算产品的纯度为___________ 。
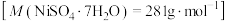 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀的pH | 7.2 | 4.0 | 2.2 | 7.5 |
| 沉淀完全的pH | 9.0 | 5.6 | 3.2 | 9.0 |
(1)“滤渣2”的成分是
(2)“调pH”可选用的物质
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为
(3)下列有关说法
| A.酸浸步骤可用水浴加热,以加速反应 |
| B.操作A中的有机溶剂可选用乙醇 |
| C.调pH后过滤,需用玻璃棒对漏斗中的混合物充分搅拌 |
| D.操作B中包含“结晶、过滤、洗涤、煅烧”等操作 |
(4)测定产品的纯度。
| 操作步骤 | 涉及反应 |
| ①准确称取制备的硫酸镍样品5.620g,加入含0.0200molEDTA的二钠盐溶液(用H2Y2-表示),充分反应后定容成100mL。 | 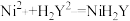 |
②取25.00mL上述溶液于锥形瓶中,加二甲酚橙作指示剂,用 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 |  |
您最近一年使用:0次
名校
解题方法
7 . 某工厂废水中含有大量的FeSO4和较多的CuSO4。为制备晶体X并检验其部分性质,按如下流程进行相关实验:

已知:①流程中一系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4;与FeSO4溶液中溶质的物质的量相等。
(1)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],请写出该反应的化学方程式:___________ 。
(2)①下列说法不正确的是___________
A.测得晶体X分子量为392,则其化学式可能为(NH4)2Fe(SO4)2·6H2O
B.晶体X中不含Fe3+,故不可以作净水剂
C.晶体X比绿矾晶体稳定的原因是(NH4)2SO4包裹在FeSO4外部,隔绝空气对Fe2+的氧化
D.结合流程图信息,测定待测KMnO4溶液浓度时,用晶体X配标准液去滴定比绿矾误差更小
②请从溶解度角度分析冷却结晶得到晶体X而非FeSO4·7H2O或(NH4)2SO4的原因:___________ 。
(3)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式:___________ 。

已知:①流程中一系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4;与FeSO4溶液中溶质的物质的量相等。
(1)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],请写出该反应的化学方程式:
(2)①下列说法不正确的是
A.测得晶体X分子量为392,则其化学式可能为(NH4)2Fe(SO4)2·6H2O
B.晶体X中不含Fe3+,故不可以作净水剂
C.晶体X比绿矾晶体稳定的原因是(NH4)2SO4包裹在FeSO4外部,隔绝空气对Fe2+的氧化
D.结合流程图信息,测定待测KMnO4溶液浓度时,用晶体X配标准液去滴定比绿矾误差更小
②请从溶解度角度分析冷却结晶得到晶体X而非FeSO4·7H2O或(NH4)2SO4的原因:
(3)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式:
您最近一年使用:0次
2023-11-12更新
|
143次组卷
|
2卷引用:浙江省浙南名校联盟2023-2024学年高二上学期11月期中考试化学试题
解题方法
8 . 根据所学知识,完成下列问题
I.
(1)分类是认识和研究物质及其变化的一种常用的科学方法,如图所示分类方法是___________ (选填“树状分类法”或“交叉分类法”)。

II.现有以下物质:①NaOH溶液;②液态HCl;③ 晶体;④熔融KCl;⑤Cu;⑥
晶体;④熔融KCl;⑤Cu;⑥
(2)以上物质中属于电解质的是___________ (填序号)。
(3) 溶液和盐酸两溶液混合时反应的离子方程式
溶液和盐酸两溶液混合时反应的离子方程式___________ 。
III.高锰酸钾和氢溴酸溶液可以发生如下反应:
(4)若有2mol还原剂被氧化,则转移电子的物质的量为___________ mol。
I.
(1)分类是认识和研究物质及其变化的一种常用的科学方法,如图所示分类方法是

II.现有以下物质:①NaOH溶液;②液态HCl;③
 晶体;④熔融KCl;⑤Cu;⑥
晶体;④熔融KCl;⑤Cu;⑥
(2)以上物质中属于电解质的是
(3)
 溶液和盐酸两溶液混合时反应的离子方程式
溶液和盐酸两溶液混合时反应的离子方程式III.高锰酸钾和氢溴酸溶液可以发生如下反应:

(4)若有2mol还原剂被氧化,则转移电子的物质的量为
您最近一年使用:0次
解题方法
9 . 工业烟气中通常含有高浓度 、CO、
、CO、 等有害物质,排放前无害化处理是化学研究的重要课题。
等有害物质,排放前无害化处理是化学研究的重要课题。
(1)利用羟基自由基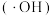 氧化转化是烟气中除去
氧化转化是烟气中除去 重要化学方法。
重要化学方法。 在催化剂
在催化剂 的表面上分解产生
的表面上分解产生 ,
, 再与烟气中的NO发生反应,生成硝酸等物质。
再与烟气中的NO发生反应,生成硝酸等物质。
①写出 氧化NO的化学反应方程式
氧化NO的化学反应方程式___________ 。
②当 浓度一定时,NO的脱除效率与温度的关系如图所示。升温至80℃以上,NO的脱除效率提高主要有两方面原因,一方面是:大量汽化的
浓度一定时,NO的脱除效率与温度的关系如图所示。升温至80℃以上,NO的脱除效率提高主要有两方面原因,一方面是:大量汽化的 吸附在催化剂表面,分解产生高浓度的
吸附在催化剂表面,分解产生高浓度的 ,加快反应速率;另一方面是:
,加快反应速率;另一方面是:___________ ;温度高于180℃,NO的脱除效率降低的原因是___________ 。

(2)某科研机构探索出 催化烟气回收硫方法:
催化烟气回收硫方法: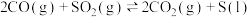
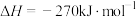 ,380℃时,
,380℃时, 和
和 投料比为1:1时
投料比为1:1时 转化率的变化如图所示,请在图中画出
转化率的变化如图所示,请在图中画出 和
和 投料比为1:3时,
投料比为1:3时, 转化率变化曲线
转化率变化曲线______________ 。

(3)采用碱性的 溶液作为吸收剂,可将烟气中
溶液作为吸收剂,可将烟气中 和NO吸收。
和NO吸收。
在323K,向 的
的 溶液中通入烟气,反应一段时间后溶液中离子浓度的分析结果如下表:
溶液中通入烟气,反应一段时间后溶液中离子浓度的分析结果如下表:
① 溶液吸收NO的主要反应的离子方程式:
溶液吸收NO的主要反应的离子方程式:_______ 。
②下列有关 溶液吸收法处理烟气的说法不正确
溶液吸收法处理烟气的说法不正确_______ 。
A.升高反应温度,一定有利于提高烟气中NO和 的吸收效率
的吸收效率
B. 溶液吸收
溶液吸收 的离子方程式可表示为:
的离子方程式可表示为:
C.随着吸收反应的进行,吸收剂溶液的pH会逐渐变大
D.数据说明NO吸收效率低于 ,可能原因是NO溶解度比
,可能原因是NO溶解度比 小
小
 、CO、
、CO、 等有害物质,排放前无害化处理是化学研究的重要课题。
等有害物质,排放前无害化处理是化学研究的重要课题。(1)利用羟基自由基
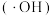 氧化转化是烟气中除去
氧化转化是烟气中除去 重要化学方法。
重要化学方法。 在催化剂
在催化剂 的表面上分解产生
的表面上分解产生 ,
, 再与烟气中的NO发生反应,生成硝酸等物质。
再与烟气中的NO发生反应,生成硝酸等物质。①写出
 氧化NO的化学反应方程式
氧化NO的化学反应方程式②当
 浓度一定时,NO的脱除效率与温度的关系如图所示。升温至80℃以上,NO的脱除效率提高主要有两方面原因,一方面是:大量汽化的
浓度一定时,NO的脱除效率与温度的关系如图所示。升温至80℃以上,NO的脱除效率提高主要有两方面原因,一方面是:大量汽化的 吸附在催化剂表面,分解产生高浓度的
吸附在催化剂表面,分解产生高浓度的 ,加快反应速率;另一方面是:
,加快反应速率;另一方面是:
(2)某科研机构探索出
 催化烟气回收硫方法:
催化烟气回收硫方法: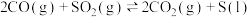
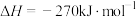 ,380℃时,
,380℃时, 和
和 投料比为1:1时
投料比为1:1时 转化率的变化如图所示,请在图中画出
转化率的变化如图所示,请在图中画出 和
和 投料比为1:3时,
投料比为1:3时, 转化率变化曲线
转化率变化曲线
(3)采用碱性的
 溶液作为吸收剂,可将烟气中
溶液作为吸收剂,可将烟气中 和NO吸收。
和NO吸收。在323K,向
 的
的 溶液中通入烟气,反应一段时间后溶液中离子浓度的分析结果如下表:
溶液中通入烟气,反应一段时间后溶液中离子浓度的分析结果如下表:| 离子 |  |  |  |  |  |
| c(mol/L) | 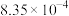 |  | 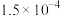 | 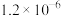 |  |
 溶液吸收NO的主要反应的离子方程式:
溶液吸收NO的主要反应的离子方程式:②下列有关
 溶液吸收法处理烟气的说法不正确
溶液吸收法处理烟气的说法不正确A.升高反应温度,一定有利于提高烟气中NO和
 的吸收效率
的吸收效率B.
 溶液吸收
溶液吸收 的离子方程式可表示为:
的离子方程式可表示为:
C.随着吸收反应的进行,吸收剂溶液的pH会逐渐变大
D.数据说明NO吸收效率低于
 ,可能原因是NO溶解度比
,可能原因是NO溶解度比 小
小
您最近一年使用:0次
10 . 某研究小组以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉,按如下流程开展实验:
已知:

①硫化铜精矿在酸性条件下与氧气反应:
②金属离子开始沉淀和沉淀完全的pH值如下表所示:
(1)步骤Ⅰ,通入 采用高压的原因是
采用高压的原因是___________ ;
(2)下列有关说法正确的是___________。
(3)步骤Ⅰ、Ⅲ需要高压反应釜装置如图。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为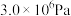 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序:______
g→___________→___________→___________→c→___________。

a.开启气阀 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀 d.开启气阀
d.开启气阀 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀 g.开启搅拌器 h.拆下罐体
g.开启搅拌器 h.拆下罐体
(4)步骤Ⅲ,高压 可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是
可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是___________ ;
(5)铜纯度的测定
步骤1:取0.200g粗铜,加入一定量浓 、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的
、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的 ,冷却;
,冷却;
步骤2:将步骤1所得溶液加水定容至250mL,量取25.00mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30.00mL。
溶液30.00mL。
已知: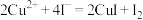 ,
,
①产品中铜的质量分数为___________ ;
②测定过程中,下列说法正确的是___________ 。
A.步骤1中若未反应的 未除尽,则导致滴定结果偏低
未除尽,则导致滴定结果偏低
B.步骤2中应先用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
C.滴定过程中,若向锥形瓶内加少量蒸馏水,则滴定结果偏低
D.滴定前平视刻度线,滴定后仰视,则测定的结果偏高
已知:

①硫化铜精矿在酸性条件下与氧气反应:

②金属离子开始沉淀和沉淀完全的pH值如下表所示:
 |  |  |  |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(1)步骤Ⅰ,通入
 采用高压的原因是
采用高压的原因是(2)下列有关说法正确的是___________。
| A.步骤Ⅰ,过滤得到的滤渣中含有S |
B.步骤Ⅱ, 调节pH至4,使 调节pH至4,使 、 、 沉淀完全 沉淀完全 |
| C.步骤Ⅲ,增加溶液的酸度不利于Cu生成 |
| D.为加快过滤速率,需用玻璃棒对漏斗中的沉淀进行充分搅拌 |
(3)步骤Ⅰ、Ⅲ需要高压反应釜装置如图。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的
 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为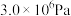 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序:g→___________→___________→___________→c→___________。

a.开启气阀
 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀 d.开启气阀
d.开启气阀 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀 g.开启搅拌器 h.拆下罐体
g.开启搅拌器 h.拆下罐体(4)步骤Ⅲ,高压
 可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是
可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是(5)铜纯度的测定
步骤1:取0.200g粗铜,加入一定量浓
 、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的
、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的 ,冷却;
,冷却;步骤2:将步骤1所得溶液加水定容至250mL,量取25.00mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30.00mL。
溶液30.00mL。已知:
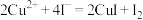 ,
,
①产品中铜的质量分数为
②测定过程中,下列说法正确的是
A.步骤1中若未反应的
 未除尽,则导致滴定结果偏低
未除尽,则导致滴定结果偏低B.步骤2中应先用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
C.滴定过程中,若向锥形瓶内加少量蒸馏水,则滴定结果偏低
D.滴定前平视刻度线,滴定后仰视,则测定的结果偏高
您最近一年使用:0次



