1 . Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图是硫元素的价类二维图,回答下列问题:

(1) 为
为______ (填物质的类别); 的化学式为
的化学式为______ ;
(2)某同学欲选用如图的部分装置和药品探究: 的性质。
的性质。
上述装置中能体现 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为______________________________________ 。
(3)下图是工业上用黄铁矿(主要成分 )为原料制取绿矾(
)为原料制取绿矾(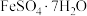 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式:______ 以及反应室中发生的化学方程式:______ ;实验小组在实验室模拟该工艺流程,用75g的黄铁矿制备出了139g绿矾,黄铁矿中 的质量分数约为
的质量分数约为______ 。

Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为:
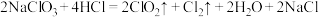
①氧化性:
______ (填“>”或“<”) 。
。
② 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为______ 。
(5)将下述氧化还原反应配平___________
______ +______
+______ +______
+______
 ______
______ +______
+______ +______
+______

(1)
 为
为 的化学式为
的化学式为(2)某同学欲选用如图的部分装置和药品探究:
 的性质。
的性质。
|
|
|
|
|
A | B | C | D | E |
 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为(3)下图是工业上用黄铁矿(主要成分
 )为原料制取绿矾(
)为原料制取绿矾(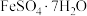 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式: 的质量分数约为
的质量分数约为
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: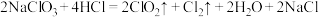
①氧化性:

 。
。②
 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为(5)将下述氧化还原反应配平
______
 +______
+______ +______
+______
 ______
______ +______
+______ +______
+______
您最近一年使用:0次
2 .  在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
I. 的性质探究
的性质探究
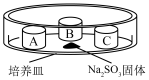
装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向 固体上滴加
固体上滴加 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
(1)70%浓硫酸溶液和 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为________________________________ 。
(2)瓶盖A中发生反应的化学方程式为________________________________ 。
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是_______ (填字母)。
a. 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液
(4)瓶盖_______ (填字母)中的实验现象能证明 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为______________ 。
(5)综合上述实验信息可证明 具有还原性、
具有还原性、___________________________________ 等性质。
(6)增加瓶盖D可验证 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是__________________________ 。
II.化石燃料燃烧会产生大量的 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是 小于
小于_______________ 的降雨。
(8)方法I中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为: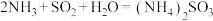 、
、__________ 。
(9)方法II中用 将
将 还原为S时,
还原为S时, 转化为
转化为_______________ (填化学式)。
(10)对方法III吸收 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的___________ 反应。
 在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。I.
 的性质探究
的性质探究装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向
 固体上滴加
固体上滴加 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。实验装置 | 㼛盖 | 物质 | 实验现象 |
| A | 蒸馏水 | 无明显变化 |
B |
| 溶液褪色 | |
C | 蘸有品红溶液的棉花 | 品红溶液褪色 |
(1)70%浓硫酸溶液和
 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为(2)瓶盖A中发生反应的化学方程式为
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是
a.
 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液(4)瓶盖
 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为(5)综合上述实验信息可证明
 具有还原性、
具有还原性、(6)增加瓶盖D可验证
 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是II.化石燃料燃烧会产生大量的
 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。方法1 | 用氨水将 转化为 转化为 ,再氧化成 ,再氧化成 |
方法2 | 用生物质热解气(主要成分 、 、 、 、 )将 )将 在高温下还原成单质硫,其他生成物均可直接排放 在高温下还原成单质硫,其他生成物均可直接排放 |
方法3 | 用 溶液吸收 溶液吸收 ,再经电解转化为 ,再经电解转化为 |
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是
 小于
小于(8)方法I中氨水吸收燃煤烟气中
 的化学反应为:
的化学反应为: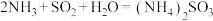 、
、(9)方法II中用
 将
将 还原为S时,
还原为S时, 转化为
转化为(10)对方法III吸收
 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
您最近一年使用:0次
2024-01-17更新
|
134次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
3 . 如图是自然界中不同价态硫元索之间的转化关系图,按要求回答问题:

(1)写出图中两种物质混合生成S,且S既是氧化产物又是还原产物的化学方程式____________________ 。
(2)工业生产硫酸的方法之一是:
①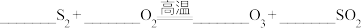 ,配平该反应方程式
,配平该反应方程式____________ ;
②__________________ ,写出该反应的方程式;
③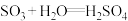 。
。
(3) 可用于焊接钢轨,写出该反应的化学方程式
可用于焊接钢轨,写出该反应的化学方程式___________________ 。
(4)硫酸是重要的化工原料,写出加热时铜和浓硫酸反应的化学方程式:____________________________ ,生成标准状况下 的还原性气体,转移的电子数为
的还原性气体,转移的电子数为_________________ 。

(1)写出图中两种物质混合生成S,且S既是氧化产物又是还原产物的化学方程式
(2)工业生产硫酸的方法之一是:
①
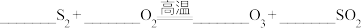 ,配平该反应方程式
,配平该反应方程式②
③
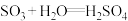 。
。(3)
 可用于焊接钢轨,写出该反应的化学方程式
可用于焊接钢轨,写出该反应的化学方程式(4)硫酸是重要的化工原料,写出加热时铜和浓硫酸反应的化学方程式:
 的还原性气体,转移的电子数为
的还原性气体,转移的电子数为
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)从海水中得到的粗盐中常含 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入_______ 、_______ 、_______ 、稀盐酸来进行提纯。加入适量盐酸的目的是_______ 。
(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。
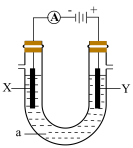
①写出该电解反应的化学方程式_______ 。
②简述检测Y极附近产生的气体的实验方案:_______
(3)下列方法可用于海水淡化的是_______ (填字母)。
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂, 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为_______ 。
②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:_______ 。
(5)目前很多自来水厂使用 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: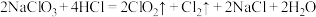 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况_______ 。
(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为_______ 。
②软锰矿(主要成分 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为_______ 。
(1)从海水中得到的粗盐中常含
 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。

①写出该电解反应的化学方程式
②简述检测Y极附近产生的气体的实验方案:
(3)下列方法可用于海水淡化的是
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂,
 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:(5)目前很多自来水厂使用
 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: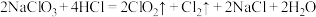 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和
 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为②软锰矿(主要成分
 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
5 . 铋酸钠(NaBiO3)浅黄色、不溶于冷水、与沸水或酸溶液反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将Bi(OH)3(白色,难溶于水)氧化制取(NaBiO3),并探究其性质。各实验装置如下图所示:
(1)装置的连接顺序是:________ (填装置下面的字母)
___________→___________→___________→___________。
(2)仪器a的名称是___________ ;装置C的作用是___________ 。
(3)当观察到B中白色固体转化为淡黄色固体且黄色不再加深时,可以判断B中反应已经完成,下一步应进行的操作是___________ 。
(4)装置B中发生反应的离子方程式为___________ 。
(5)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比(NaBiO3)强。请你向该同学解释其原因
的氧化性比(NaBiO3)强。请你向该同学解释其原因___________ 。
(6)为测定产品的纯度。取上述(NaBiO3)产品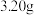 ,用足量硫酸和
,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成
,再将其准确配制成 溶液,取出
溶液,取出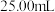 ,用
,用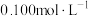 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗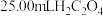 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为___________ 。已知: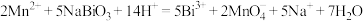 ,
, 的摩尔质量为280g/mol)
的摩尔质量为280g/mol)

(1)装置的连接顺序是:
___________→___________→___________→___________。
(2)仪器a的名称是
(3)当观察到B中白色固体转化为淡黄色固体且黄色不再加深时,可以判断B中反应已经完成,下一步应进行的操作是
(4)装置B中发生反应的离子方程式为
(5)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明
 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比(NaBiO3)强。请你向该同学解释其原因
的氧化性比(NaBiO3)强。请你向该同学解释其原因(6)为测定产品的纯度。取上述(NaBiO3)产品
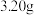 ,用足量硫酸和
,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成
,再将其准确配制成 溶液,取出
溶液,取出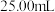 ,用
,用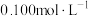 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗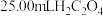 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为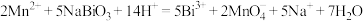 ,
, 的摩尔质量为280g/mol)
的摩尔质量为280g/mol)
您最近一年使用:0次
名校
解题方法
6 . 按要求写出下列反应方程式(1-2书写化学方程式,3-5书写离子方程式)
(1)铝粉和氧化铁粉共热(铝热反应):___________ ;
(2)实验室用铜片和浓硫酸共热制备SO2:___________ ;
(3)FeSO4溶液储存时通常加入少量铁钉的原因:___________ ;
(4)高锰酸钾溶液不能用盐酸酸化的原因:___________ ;
(5)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2气体,反应的离子方程式为___________ 。
(1)铝粉和氧化铁粉共热(铝热反应):
(2)实验室用铜片和浓硫酸共热制备SO2:
(3)FeSO4溶液储存时通常加入少量铁钉的原因:
(4)高锰酸钾溶液不能用盐酸酸化的原因:
(5)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2气体,反应的离子方程式为
您最近一年使用:0次
名校
7 . 随着科学技术的发展,许多新材料、新技术广泛应用于各个领域。
I.图1是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:
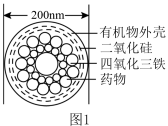
(1)“纳米药物分子车”分散于水中所得的分散系__________ (填“属于”或“不属于”)胶体。
(2)“纳米药物分子车”的外壳属于有机物。①酒精②蔗糖③冰醋酸中这三种有机物中,属于电解质的是__________ (填序号)。
(3)从元素组成的角度分析, 和
和 可归为同一类物质,其类别属于化合物中的
可归为同一类物质,其类别属于化合物中的__________ 。
Ⅱ.无土栽培技术的成功推广,营养液的准确配制是重要环节。某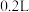 营养液中含有
营养液中含有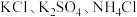 三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中
三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中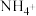 的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
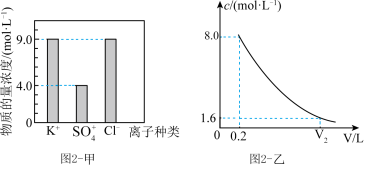
(4)该营养液中 的物质的量浓度为
的物质的量浓度为__________ 。
(5)写出一种与 含相同电子数的分子的化学式
含相同电子数的分子的化学式______________ ;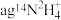 含有的中子的物质的量为
含有的中子的物质的量为__________ 。
Ⅲ.近年来,我国储氢材料的研制取得重大发展。其中电弧法合成储氢碳纳米管时,常伴有大量碳纳米颗粒杂质,这种碳纳米颗粒可用氧化气化法提纯,其反应原理如下:
_____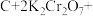 _____
_____ (稀)
(稀) ____
____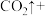 _____
_____ _____
_____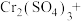 _____
_____
回答下列问题:
(6)完成上述反应的配平_________ 。
(7)某学生欲配制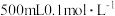 的稀硫酸,用量筒量取需要的浓硫酸,则需量取
的稀硫酸,用量筒量取需要的浓硫酸,则需量取 的浓硫酸
的浓硫酸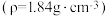 的体积为
的体积为__________ 。
(8)标准状况下,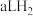 和
和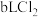 的混合气体,经强光充分照射后,所得气体恰好使含
的混合气体,经强光充分照射后,所得气体恰好使含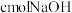 的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是____________________ 。
I.图1是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:

(1)“纳米药物分子车”分散于水中所得的分散系
(2)“纳米药物分子车”的外壳属于有机物。①酒精②蔗糖③冰醋酸中这三种有机物中,属于电解质的是
(3)从元素组成的角度分析,
 和
和 可归为同一类物质,其类别属于化合物中的
可归为同一类物质,其类别属于化合物中的Ⅱ.无土栽培技术的成功推广,营养液的准确配制是重要环节。某
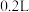 营养液中含有
营养液中含有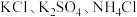 三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中
三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中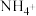 的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
(4)该营养液中
 的物质的量浓度为
的物质的量浓度为(5)写出一种与
 含相同电子数的分子的化学式
含相同电子数的分子的化学式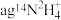 含有的中子的物质的量为
含有的中子的物质的量为Ⅲ.近年来,我国储氢材料的研制取得重大发展。其中电弧法合成储氢碳纳米管时,常伴有大量碳纳米颗粒杂质,这种碳纳米颗粒可用氧化气化法提纯,其反应原理如下:
_____
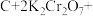 _____
_____ (稀)
(稀) ____
____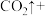 _____
_____ _____
_____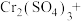 _____
_____
回答下列问题:
(6)完成上述反应的配平
(7)某学生欲配制
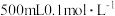 的稀硫酸,用量筒量取需要的浓硫酸,则需量取
的稀硫酸,用量筒量取需要的浓硫酸,则需量取 的浓硫酸
的浓硫酸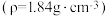 的体积为
的体积为(8)标准状况下,
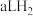 和
和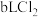 的混合气体,经强光充分照射后,所得气体恰好使含
的混合气体,经强光充分照射后,所得气体恰好使含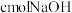 的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
您最近一年使用:0次
名校
解题方法
8 .  是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对
是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对 的实验室制备(加热装置省略)和性质实验进行研究.
的实验室制备(加热装置省略)和性质实验进行研究.

(1)实验中铜与浓硫酸反应的化学方程式是___________ .在该反应中浓硫酸体现了___________ 性。
(2)从物质类别分析 是酸性氧化物,可以使装置
是酸性氧化物,可以使装置 中的澄清石灰水变浑浊,写出
中的澄清石灰水变浑浊,写出 使澄清石灰水变浑浊的离子方程式
使澄清石灰水变浑浊的离子方程式___________ 。
(3)从化合价角度分析 既有氧化性又有还原性:
既有氧化性又有还原性:
①若C中盛有 溶液,当溶液由黄色变成浅绿色则证明
溶液,当溶液由黄色变成浅绿色则证明 具有还原性,写出该过程的离子方程式
具有还原性,写出该过程的离子方程式___________ 。
②若 中盛有
中盛有 溶液,当溶液有黄色沉淀产生,则证明
溶液,当溶液有黄色沉淀产生,则证明 具有氧化性,写出该过程的化学方程式
具有氧化性,写出该过程的化学方程式___________
(4) 还具有漂白性,则
还具有漂白性,则 中盛放的是
中盛放的是___________ 溶液。
(5)装置 的作用为
的作用为___________ 。
 是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对
是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对 的实验室制备(加热装置省略)和性质实验进行研究.
的实验室制备(加热装置省略)和性质实验进行研究.
(1)实验中铜与浓硫酸反应的化学方程式是
(2)从物质类别分析
 是酸性氧化物,可以使装置
是酸性氧化物,可以使装置 中的澄清石灰水变浑浊,写出
中的澄清石灰水变浑浊,写出 使澄清石灰水变浑浊的离子方程式
使澄清石灰水变浑浊的离子方程式(3)从化合价角度分析
 既有氧化性又有还原性:
既有氧化性又有还原性:①若C中盛有
 溶液,当溶液由黄色变成浅绿色则证明
溶液,当溶液由黄色变成浅绿色则证明 具有还原性,写出该过程的离子方程式
具有还原性,写出该过程的离子方程式②若
 中盛有
中盛有 溶液,当溶液有黄色沉淀产生,则证明
溶液,当溶液有黄色沉淀产生,则证明 具有氧化性,写出该过程的化学方程式
具有氧化性,写出该过程的化学方程式(4)
 还具有漂白性,则
还具有漂白性,则 中盛放的是
中盛放的是(5)装置
 的作用为
的作用为
您最近一年使用:0次
名校
9 . 下图是自然界中不同价态硫元素之间的转化关系图。回答下列问题:

(1)硫元素在自然界中的存在形态有___________ 和化合态,单质硫矿主要存在于___________ ; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的___________ 。
(2)H2SO4 的电离方程式为___________ 。
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2 _____Fe2O3 + _____SO2
_____Fe2O3 + _____SO2 ___________ ;
②SO2 的接触氧化;___________ ;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式___________ 。
(5)写出铜与浓硫酸反应的的化学方程式为___________ ,若反应产生672mL(标准状况)还原性气体,转移电子的数目为___________ 。

(1)硫元素在自然界中的存在形态有
(2)H2SO4 的电离方程式为
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2
 _____Fe2O3 + _____SO2
_____Fe2O3 + _____SO2 ②SO2 的接触氧化;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式
(5)写出铜与浓硫酸反应的的化学方程式为
您最近一年使用:0次
名校
10 . 填空
(1)有钠、氢、氧、硫四种元素,用其中的一种或几种元素可以组成多种物质,写出符合下列要求的化学式或化学方程式(各写一个):
①酸式盐________ ②非电解质________ ③置换反应:________ ;
(2)配平反应________  ________
________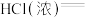 ________
________ ________
________ ________
________ ________
________ 。还原产物为
。还原产物为________ ,若有 参加反应,则参加反应的HCl为
参加反应,则参加反应的HCl为________ mol,其中被氧化的HCl为________ mol,转移电子的物质的量为________ mol
(1)有钠、氢、氧、硫四种元素,用其中的一种或几种元素可以组成多种物质,写出符合下列要求的化学式或化学方程式(各写一个):
①酸式盐
(2)配平反应
 ________
________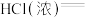 ________
________ ________
________ ________
________ ________
________ 。还原产物为
。还原产物为 参加反应,则参加反应的HCl为
参加反应,则参加反应的HCl为
您最近一年使用:0次




 酸性溶液
酸性溶液

