名校
1 . 氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________ (填化学式,下同),还原剂为_________________ ,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________ mol,反应转移的电子数是_______________ 。
(2)已知:在加热条件下,3NaClO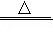 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________ (用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________ 。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为
(2)已知:在加热条件下,3NaClO
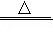 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为
您最近一年使用:0次
2 . 镉(Cd)是一种用途广泛的金属,也是对人体健康威胁最大的有害元素之一。
(1)1.00gCdS固体完全燃烧生成CdO固体和SO2气体放出2.75kJ的热量,该反应的热化学方程式为____ 。
(2)常温下,Ksp(CdCO3) = 4.0×10-12,Ksp[Cd(OH)2] = 3.2 ×10-14,则溶解度(mol·L-1)较大的是____ [填“CdCO3”或“Cd(OH)2”];若向含112mg·L-1 Cd2+的废水加碱调pH至9.0,达到平衡时,溶液中c(Cd2+)=____ 。
(3)一种鳌合絮凝剂的制备及其用于去除含镉废水中Cd2+的原理如下:

①聚丙酰胺的单体的结构简式为____ 。
②使用鳌合絮凝剂处理某含镉废水,镉去除率与pH的关系如图-1所示。在强酸性条件下,pH越小除镉效果越差,其原因是____ 。

(4)一种用电动力学修复被镉污染的土壤的装置如图-2所示。
①实验前铁粉需依次用NaOH溶液、稀硫酸及蒸馏水洗涤,其目的是____ 。
②实验过程中铁粉上发生的电极反应为____ 。
③活性炭的作用是____ 。
(1)1.00gCdS固体完全燃烧生成CdO固体和SO2气体放出2.75kJ的热量,该反应的热化学方程式为
(2)常温下,Ksp(CdCO3) = 4.0×10-12,Ksp[Cd(OH)2] = 3.2 ×10-14,则溶解度(mol·L-1)较大的是
(3)一种鳌合絮凝剂的制备及其用于去除含镉废水中Cd2+的原理如下:

①聚丙酰胺的单体的结构简式为
②使用鳌合絮凝剂处理某含镉废水,镉去除率与pH的关系如图-1所示。在强酸性条件下,pH越小除镉效果越差,其原因是

(4)一种用电动力学修复被镉污染的土壤的装置如图-2所示。
①实验前铁粉需依次用NaOH溶液、稀硫酸及蒸馏水洗涤,其目的是
②实验过程中铁粉上发生的电极反应为
③活性炭的作用是
您最近一年使用:0次
名校
解题方法
3 . 硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
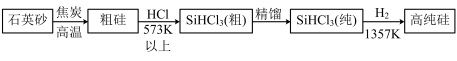
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________ 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_____________________ ;H2还原SiHCl3过程中若混入O2,可能引起的后果是_______________________ 。
(2)下列有关硅材料的说法正确的是________ 。
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为___________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为________ ,水玻璃在工业上有许多用途,试举出一例________ 。
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式
(2)下列有关硅材料的说法正确的是________ 。
| A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大 |
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为
您最近一年使用:0次
2018-04-30更新
|
408次组卷
|
2卷引用:江苏省启东中学2017-2018学年高一下学期期中考试化学试题
名校
4 . 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
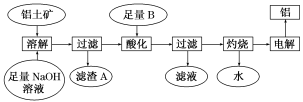
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
________________________________________________________________________ 。
(2)在工艺流程中“酸化”时,加入的最佳物质B是______ ,理由是________________________________________________________________________ ,
写出酸化过程发生反应的化学方程式________________________________________________________________________ 。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为______________________________ 。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是________ (填化学式),请判断该同学设计的实验方案的合理性________ (填“合理”或“不合理”)。原因是_____________________________ (若合理,则不用填写)。

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
(2)在工艺流程中“酸化”时,加入的最佳物质B是
写出酸化过程发生反应的化学方程式
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是
您最近一年使用:0次
2017-05-24更新
|
999次组卷
|
8卷引用:江苏省启东中学2020-2021学年高一上学期第二次月考化学试题
江苏省启东中学2020-2021学年高一上学期第二次月考化学试题河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题【全国百强校】广西陆川县中学2017-2018学年高一下学期6月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【押题专练】宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
5 . NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g) 2 NH3 (g) H =
2 NH3 (g) H =_____ kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H2 2NH3,测得各组分浓度随时间变化如图8所示。
2NH3,测得各组分浓度随时间变化如图8所示。
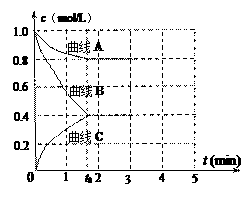
①表示c(N2)的曲线是__________ (填“曲线A”、“曲线B”或“曲线C”)。
② 0~t0时用H2表示的反应速率:v(H2)=___________________ mol·L-1·min-1。
③ 下列能说明该反应达到平衡的是________ 。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
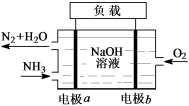
① 电极b名称是__________ 。
② 电解质溶液中OH-离子向________ 移动(填“电极a”或“电极b”)。
③电极a的电极反应式为______________________ 。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是___________________________________________ 。
(1)已知:
| 共价键 | H―H | N≡N | N―H |
| 键能/ kJ·mol-1 | 436 | 946 | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)
 2 NH3 (g) H =
2 NH3 (g) H =(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H2
 2NH3,测得各组分浓度随时间变化如图8所示。
2NH3,测得各组分浓度随时间变化如图8所示。
①表示c(N2)的曲线是
② 0~t0时用H2表示的反应速率:v(H2)=
③ 下列能说明该反应达到平衡的是
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:

① 电极b名称是
② 电解质溶液中OH-离子向
③电极a的电极反应式为
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是
您最近一年使用:0次
2017-07-02更新
|
823次组卷
|
5卷引用:江苏省扬州市2016-2017学年高一下学期期末调研化学试题2
名校
解题方法
6 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
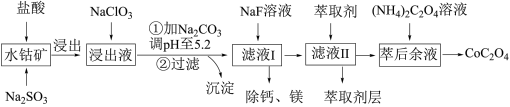
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:江苏省扬州中学2017届高三下学期期中考试化学试题
7 . 锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_____________ 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③_________________ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是_________ ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是_____________ 。
(5)步骤Ⅳ中,在_____ (填“阴”或“阳”)极析出Mn,电极反应方程式为_________ 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥_____ mol·L-1。

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是
(4)步骤Ⅲ中,滤渣2的主要成分是
(5)步骤Ⅳ中,在
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥
您最近一年使用:0次
11-12高三上·江苏常州·期中
8 . 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
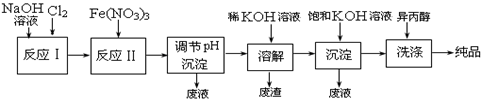
①反应I的化学方程式为___________________ 。
②反应II的离子方程式为_______________________ 。
③加入饱和KOH溶液的目的是__________________________ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为_________________ ;___________________ 。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为______________ 。
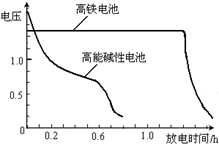
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有______________ ;_____________ 。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:

|
①反应I的化学方程式为
②反应II的离子方程式为
③加入饱和KOH溶液的目的是
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有

您最近一年使用:0次
2010·江苏盐城·一模
9 . 空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是___________ 。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
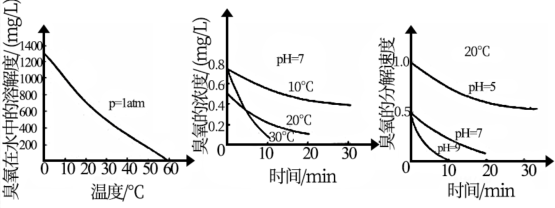
用臭氧消毒自来水,适宜的条件是_______________________ 。
(3)2O3(g)=3O2(g) △H=-285kJ/mol,2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为:_________________________ 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式:__________________________ 。
(1)下列有关说法正确的是
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:

用臭氧消毒自来水,适宜的条件是
(3)2O3(g)=3O2(g) △H=-285kJ/mol,2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为:
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式:
您最近一年使用:0次



