解题方法
1 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、SO 等)可制备强氧化剂K2Cr2O7。.
等)可制备强氧化剂K2Cr2O7。.

已知:pH>6.5时Cr(VI)主要以CrO 形式存在,pH<6.5时Cr(VI)主要以Cr2O
形式存在,pH<6.5时Cr(VI)主要以Cr2O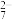 形式存在。
形式存在。
(1)含铬废液中存在[Cr(H2O)4Cl2]+,该微粒的中心离子基态核外电子排布式为____ 。
(2)写出调节pH约为12时Cr3+被氧化为Cr(VI)的离子方程式:____ 。
(3)加稀硫酸至溶液pH约为1。若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是____ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol·L-1K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。.
①理论上需要向反应釜中加入蔗糖的物质的量为____ 。
②测得一定温度下,反应釜内的压强和K2Cr2O7转化率与反应时间的关系如图所示,28~35min,压强减小的原因是____ 。

(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.10000mol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数____ (写出计算过程)。
 等)可制备强氧化剂K2Cr2O7。.
等)可制备强氧化剂K2Cr2O7。.
已知:pH>6.5时Cr(VI)主要以CrO
 形式存在,pH<6.5时Cr(VI)主要以Cr2O
形式存在,pH<6.5时Cr(VI)主要以Cr2O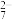 形式存在。
形式存在。(1)含铬废液中存在[Cr(H2O)4Cl2]+,该微粒的中心离子基态核外电子排布式为
(2)写出调节pH约为12时Cr3+被氧化为Cr(VI)的离子方程式:
(3)加稀硫酸至溶液pH约为1。若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol·L-1K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。.
①理论上需要向反应釜中加入蔗糖的物质的量为
②测得一定温度下,反应釜内的压强和K2Cr2O7转化率与反应时间的关系如图所示,28~35min,压强减小的原因是

(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.10000mol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
您最近一年使用:0次
名校
解题方法
2 . 草酸(H2C2O4)及草酸盐用途广泛。
(一)草酸是一种易溶于水的二元有机弱酸,可与酸性KMnO4溶液发生反应:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。回答下列问题:
+6H+=2Mn2++10CO2↑+8H2O。回答下列问题:
(1)若0.5molH2C2O4被氧化,转移电子____ mol。
(2)对比实验____ ,可探究浓度对反应速率的影响。
(3)对比实验____ ,可探究温度对反应速率的影响。
(4)已知Mn2+对H2C2O4和KMnO4的反应有催化作用。实验2中产生CO2的速率v(CO2)与时间t的关系如图所示。试说明理由:____ 。

(二)草酸亚铁(FeC2O4•2H2O)可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。
(5)将Li2CO3、FeC2O4•2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时,即可制成硅酸亚铁锂,该反应的化学方程式为:____ 。
(6)该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4。写出相应的电极反应式:正极____ 。
(一)草酸是一种易溶于水的二元有机弱酸,可与酸性KMnO4溶液发生反应:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。回答下列问题:
+6H+=2Mn2++10CO2↑+8H2O。回答下列问题:| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol·L-1H2C2O4溶液 | 0.01mol·L-1KMnO4溶液 | 3.0mol·L-1稀H2SO4 | 水 | 温度/℃ | ||
| 1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
| 3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
(1)若0.5molH2C2O4被氧化,转移电子
(2)对比实验
(3)对比实验
(4)已知Mn2+对H2C2O4和KMnO4的反应有催化作用。实验2中产生CO2的速率v(CO2)与时间t的关系如图所示。试说明理由:

(二)草酸亚铁(FeC2O4•2H2O)可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。
(5)将Li2CO3、FeC2O4•2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时,即可制成硅酸亚铁锂,该反应的化学方程式为:
(6)该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4。写出相应的电极反应式:正极
您最近一年使用:0次
名校
解题方法
3 . 铜、磷及其化合物在生产、生活中有重要的用途,回答下列问题:
(1)磷的一种化合物叫亚磷酸(H3PO3)。已知:(i)0.1 mol·L-1 H3PO3溶液的pH=1.7;(ii)H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3;(iii)H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
①关于H3PO3的说法:a.强酸 b.弱酸c.二元酸 d.三元酸 e.氧化性酸 f.还原性酸,其中正确的是___________ 。
A.bdf B.ade C.bcf D.bce
②写出H3PO3与过量NaOH溶液反应的离子方程式___________ 。
③Na2HPO3为___________ (填“正盐”或“酸式盐”)。
(2)碘化亚铜可作催化剂、饲料添加剂等。已知:Ⅰ.铜能与氢碘酸发生置换反应得到氢气和碘化亚铜;Ⅱ.CuSO4溶液能使淀粉KI试纸变蓝,并产生白色固体;Ⅲ.碘化亚铜与氢氧化钠作用生成氧化亚铜、碘化钠和水。
①下列关于碘化亚铜的叙述正确的是___________ 。
a.碘化亚铜的化学式为CuI,属于盐类
b.碘化亚铜稳定且难溶于水
c.氧化亚铜是弱酸,比碘化亚铜更难溶
d.铜能与氢碘酸反应,说明氢碘酸是强氧化性的酸
②碘化亚铜与氢氧化钠反应的离子方程式为___________ 。
(1)磷的一种化合物叫亚磷酸(H3PO3)。已知:(i)0.1 mol·L-1 H3PO3溶液的pH=1.7;(ii)H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3;(iii)H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
①关于H3PO3的说法:a.强酸 b.弱酸c.二元酸 d.三元酸 e.氧化性酸 f.还原性酸,其中正确的是
A.bdf B.ade C.bcf D.bce
②写出H3PO3与过量NaOH溶液反应的离子方程式
③Na2HPO3为
(2)碘化亚铜可作催化剂、饲料添加剂等。已知:Ⅰ.铜能与氢碘酸发生置换反应得到氢气和碘化亚铜;Ⅱ.CuSO4溶液能使淀粉KI试纸变蓝,并产生白色固体;Ⅲ.碘化亚铜与氢氧化钠作用生成氧化亚铜、碘化钠和水。
①下列关于碘化亚铜的叙述正确的是
a.碘化亚铜的化学式为CuI,属于盐类
b.碘化亚铜稳定且难溶于水
c.氧化亚铜是弱酸,比碘化亚铜更难溶
d.铜能与氢碘酸反应,说明氢碘酸是强氧化性的酸
②碘化亚铜与氢氧化钠反应的离子方程式为
您最近一年使用:0次
2021-09-30更新
|
243次组卷
|
2卷引用:江苏省连云港市灌云县第一中学2021-2022学年高三上学期第一次学情检测化学试题
2021·河北衡水·模拟预测
名校
解题方法
4 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
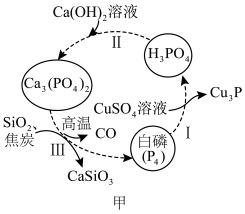
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为___________ ,过程Ⅲ的化学方程式为___________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:
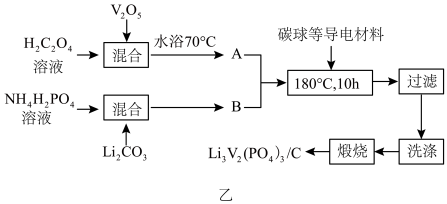
①向复合材料中加入碳单质的作用是___________ 。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为___________ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,___________ ,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用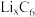 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为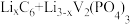 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为___________ 。
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:

①向复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用
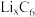 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为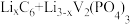 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
您最近一年使用:0次
2022-02-22更新
|
824次组卷
|
6卷引用:押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)河北省衡水中学2021-2022学年高三上学期五调考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题河北省新乐市第一中学2023-2024学年上学期高三第一次月考化学试题
名校
解题方法
5 . 草酸钴用途广泛,可用于指示剂和催化剂制备。
(1)向硫酸钴溶液中加入草酸铵溶液,可以制备得到草酸钴固体,检验草酸钴固体是否洗净的实验操作____ 。
(2)在空气中加热10.98g草酸钴晶体(CoC2O4·2H2O),受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,加热到210~320℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为____ 。
(3)钴有多种氧化物,其中Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为____ 。
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数,进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热。已知该条件下Co2+不被氧化,5CoC2O4~2KMnO4。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,共用去FeSO4溶液18.00mL。计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数___ (写出计算过程)。
(1)向硫酸钴溶液中加入草酸铵溶液,可以制备得到草酸钴固体,检验草酸钴固体是否洗净的实验操作
(2)在空气中加热10.98g草酸钴晶体(CoC2O4·2H2O),受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/ | 8.82 | 4.82 | 4.50 |
(3)钴有多种氧化物,其中Co3O4可用作电极,若选用KOH电解质溶液,通电时可转化为CoOOH,其电极反应式为
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数,进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热。已知该条件下Co2+不被氧化,5CoC2O4~2KMnO4。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,共用去FeSO4溶液18.00mL。计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数
您最近一年使用:0次
名校
解题方法
6 . 钴是元素周期表第四周期第Ⅷ族元素,其化合物用途广泛。如: 作锂电池的正极材料。
作锂电池的正极材料。
I.(1)基态Co原子的价层电子排布式为_______ 。
II.利用原钴矿 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
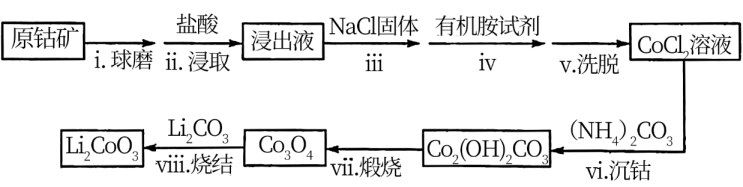
资料:①在含一定量 的溶液中:
的溶液中: 。
。
② 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
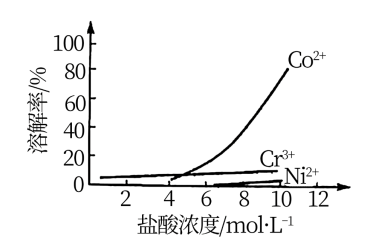
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
(2)步骤i的目的是_______ 。
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:_______ 。
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是_______ 。
(5)步骤vi用 作沉钴剂,在一定条件下得到碱式碳酸钴
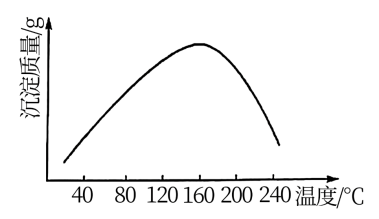
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因___ 。
(6)步骤vi沉钴中(常温下进行),若滤液中 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为___ 。
(7)步骤viii中 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是_______ 。
 作锂电池的正极材料。
作锂电池的正极材料。I.(1)基态Co原子的价层电子排布式为
II.利用原钴矿
 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量
 的溶液中:
的溶液中: 。
。②
 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:

(2)步骤i的目的是
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是
(5)步骤vi用
 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
(6)步骤vi沉钴中(常温下进行),若滤液中
 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为
(7)步骤viii中
 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是
您最近一年使用:0次
2021-03-04更新
|
253次组卷
|
2卷引用:江苏省南京市中华中学 2021-2022学年高三上学期第一次月考化学试题
名校
7 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应: NaNO2+HI=NO↑+NaI+I2+H2O(未配平)
(1)将方程式配平:_______NaNO2+_______HI =_______NO↑+_______NaI+_______I2+_______H2O
_________
(2)用双线桥法 标出该反应中电子转移的方向及数目:_______ ,被氧化的原子与被还原的原子数目之比为_______ 。
(3) HI在反应中表现的性质是_______ (填序号)
①只有还原性 ②只有氧化性 ③还原性和酸性 ④氧化性和酸性
(4)自来水中的NO 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO ,产物是N2,发生的反应可用离子方程式表示如下,完成方程式并配平。
,产物是N2,发生的反应可用离子方程式表示如下,完成方程式并配平。
_______Mg+_______ NO +_______=_______Mg(OH)2+_______N2↑+_______
+_______=_______Mg(OH)2+_______N2↑+_______
_________
(1)将方程式配平:_______NaNO2+_______HI =_______NO↑+_______NaI+_______I2+_______H2O
(2)用
(3) HI在反应中表现的性质是
①只有还原性 ②只有氧化性 ③还原性和酸性 ④氧化性和酸性
(4)自来水中的NO
 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO ,产物是N2,发生的反应可用离子方程式表示如下,完成方程式并配平。
,产物是N2,发生的反应可用离子方程式表示如下,完成方程式并配平。_______Mg+_______ NO
 +_______=_______Mg(OH)2+_______N2↑+_______
+_______=_______Mg(OH)2+_______N2↑+_______
您最近一年使用:0次
8 . 化学与经济和社会的发展关系密切,在人类文明的可持续发展中发挥着日益重要的作用。
(1)物质的结构决定性质,物质的制取和用途等是性质的体现。
①下列试剂需保存在棕色试剂瓶中的是_______ (填字母)。
a.新制氯水 b.浓硫酸 c.NaOH溶液
②工业冶铁和生产普通玻璃都要用到的原料是_______ (填名称)。
③已知:5KI+KIO3+6HCl=6KCI+3Cl2↑+3H2O,向加碘食盐(含KIO3)中加入盐酸酸化的KI和淀粉溶液,出现的现象是_______
④生产中可用浓氨水检验氯气管道是否漏气。若管道漏气,用浓氨水检查时会产生白烟。已知该反应有氮气生成,且为置换反应,反应的化学方程式为_______ 。
(2)化学是环境科学的基础,能够保护生态环境实现人与自然和谐相处。
①下列环境问题与所对应的物质不相关的是_______ (填字母)。
a.酸雨—二氧化碳 b.臭氧层破坏—氟氯烃 c.光化学污染—氮氧化物
②漂白粉可用于生活用水的杀菌消毒,漂白粉的有效成分是_______ (填化学式)。
③工业上采用向燃煤中加入石灰石,以减少燃煤过程中SO2的排放,发生的化学反应为:CaCO3+O2+SO2—CaSO4+CO2请配平化学方程式,并标出电子转移的方向和数目___ 。
(3)工业上可通过高温分解FeSO4的方法制备Fe2O3,同时生成SO2和SO3两种气体。为检验这两种硫的氧化物,可将产生的气体通入如图所示的装置中进行实验。

①写出FeSO4,高温分解的化学反应方程式:_________
②实验中可以观察到现象为_______
③实验中NaOH溶液的作用_______
(1)物质的结构决定性质,物质的制取和用途等是性质的体现。
①下列试剂需保存在棕色试剂瓶中的是
a.新制氯水 b.浓硫酸 c.NaOH溶液
②工业冶铁和生产普通玻璃都要用到的原料是
③已知:5KI+KIO3+6HCl=6KCI+3Cl2↑+3H2O,向加碘食盐(含KIO3)中加入盐酸酸化的KI和淀粉溶液,出现的现象是
④生产中可用浓氨水检验氯气管道是否漏气。若管道漏气,用浓氨水检查时会产生白烟。已知该反应有氮气生成,且为置换反应,反应的化学方程式为
(2)化学是环境科学的基础,能够保护生态环境实现人与自然和谐相处。
①下列环境问题与所对应的物质不相关的是
a.酸雨—二氧化碳 b.臭氧层破坏—氟氯烃 c.光化学污染—氮氧化物
②漂白粉可用于生活用水的杀菌消毒,漂白粉的有效成分是
③工业上采用向燃煤中加入石灰石,以减少燃煤过程中SO2的排放,发生的化学反应为:CaCO3+O2+SO2—CaSO4+CO2请配平化学方程式,并标出电子转移的方向和数目
(3)工业上可通过高温分解FeSO4的方法制备Fe2O3,同时生成SO2和SO3两种气体。为检验这两种硫的氧化物,可将产生的气体通入如图所示的装置中进行实验。

①写出FeSO4,高温分解的化学反应方程式:
②实验中可以观察到现象为
③实验中NaOH溶液的作用
您最近一年使用:0次
9 . 一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+,如5NO
和Mn2+,如5NO +2MnO
+2MnO +6H+=5NO
+6H+=5NO +2Mn2++3H2O。
+2Mn2++3H2O。
I.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示:
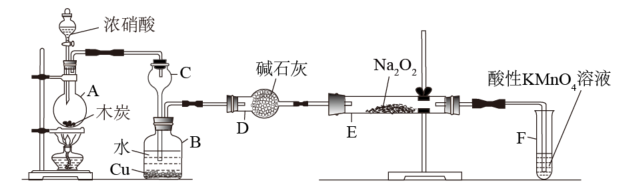
(1)A中观察到的现象是_______ 。
(2)B中反应的两个离子方程式分别是_______ 、_______ 。
(3)装置F的作用是_______ 。
II.某研究性学习小组对NO2和Na2O2能否发生反应进行探究。
[提出假设]假设一:NO2与Na2O2不反应:假设二:NO2能被Na2O2氧化;假设三 :_______ 。
[设计实验]
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设_______ 不成立。
(2)若假设二成立,则反应的化学方程式是_______ 。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成表中内容。(可供选择的试剂有:稀硫酸、稀盐酸、氯化铁溶液、高锰酸钾溶液。)
已知:①室温下,2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO
 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+,如5NO
和Mn2+,如5NO +2MnO
+2MnO +6H+=5NO
+6H+=5NO +2Mn2++3H2O。
+2Mn2++3H2O。I.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示:

(1)A中观察到的现象是
(2)B中反应的两个离子方程式分别是
(3)装置F的作用是
II.某研究性学习小组对NO2和Na2O2能否发生反应进行探究。
[提出假设]假设一:NO2与Na2O2不反应:假设二:NO2能被Na2O2氧化;假设三 :
[设计实验]
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设
(2)若假设二成立,则反应的化学方程式是
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成表中内容。(可供选择的试剂有:稀硫酸、稀盐酸、氯化铁溶液、高锰酸钾溶液。)
| 实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,加蒸馏水溶解, |
您最近一年使用:0次
20-21高三·江苏·开学考试
解题方法
10 . 钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:

请回答下列问题:
(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有___________ 。MoS2焙烧时得到+6价钼的氧化物,焙烧时的化学方程式为___________ 。
(2)向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为___________ 。
(3)为了提高原料的利用率,工艺流程中“滤渣1”应循环到___________ 操作。
(4)“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是___________ 。
(5)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是___________ 。
(6)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是___________ 。
(7)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是___________ 。

请回答下列问题:
(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有
(2)向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为
(3)为了提高原料的利用率,工艺流程中“滤渣1”应循环到
(4)“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是
(5)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是
(6)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是
(7)工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是
您最近一年使用:0次



