名校
解题方法
1 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠(NaClO2)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为_______。
(2)我国从2000年起逐步用ClO2气体替代氯气进行消毒,实验室常用KClO3、草酸(H2C2O4)和稀硫酸制备ClO2,草酸被氧化成CO2,则该反应的离子方程式为_______ 。
(3)工业上可利用ClO2制备亚氯酸钠(NaClO2),反应体系中涉及下列物质:NaClO2、ClO2、H2O2、NaOH、H2O、 ,写出反应的化学方程式:
,写出反应的化学方程式:_______ 。
(4)请完成该过程的化学方程式并配平_______ 。
_______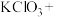 _______
_______ _______
_______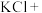 _______
_______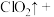 _______
_______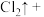 _______
_______
若反应生成71g Cl2,被氧化的HCl的物质的量为_______ 。
(5)实验室用下列方法均可制取氯气
①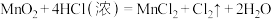
②
③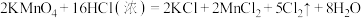
④
若各反应转移的电子数相同,①②③④生成的氯气的物质的量之比为_______ 。
(1)亚氯酸钠(NaClO2)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为_______。
| A.NaCl、Cl2 | B.NaCl、NaClO |
| C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
(3)工业上可利用ClO2制备亚氯酸钠(NaClO2),反应体系中涉及下列物质:NaClO2、ClO2、H2O2、NaOH、H2O、
 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)请完成该过程的化学方程式并配平
_______
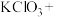 _______
_______ _______
_______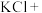 _______
_______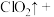 _______
_______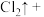 _______
_______若反应生成71g Cl2,被氧化的HCl的物质的量为
(5)实验室用下列方法均可制取氯气
①
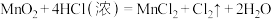
②

③
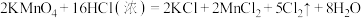
④

若各反应转移的电子数相同,①②③④生成的氯气的物质的量之比为
您最近半年使用:0次
解题方法
2 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
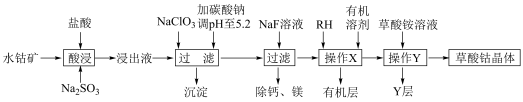
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液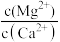 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
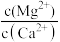 =
=
您最近半年使用:0次
3 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近半年使用:0次
解题方法
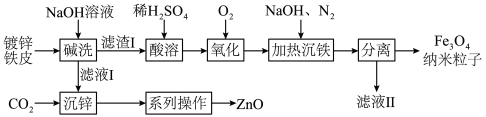
4 . 纳米 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
查阅资料: 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。
回答下列问题:
(1)“碱洗”时, 溶液的作用是
溶液的作用是___________________ 。
(2)“沉锌”时,选用 而不用盐酸的依据是
而不用盐酸的依据是___________________ ,该反应的离子方程式为__________________________ 。
(3)“系列操作”包括过滤、____________ 。
(4)“氧化”后的溶液中所含金属阳离子有________________________ (填离子符号)。
(5)文献表明,若“氧化”时,溶液 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______________________ 。
(6)检验“分离”得到的 是否洗净的操作为
是否洗净的操作为______________________ 。
(7)某化学兴趣小组用 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为______ (保留三位有效数字)。
 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
查阅资料:
 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。回答下列问题:
(1)“碱洗”时,
 溶液的作用是
溶液的作用是(2)“沉锌”时,选用
 而不用盐酸的依据是
而不用盐酸的依据是(3)“系列操作”包括过滤、
(4)“氧化”后的溶液中所含金属阳离子有
(5)文献表明,若“氧化”时,溶液
 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为(6)检验“分离”得到的
 是否洗净的操作为
是否洗净的操作为(7)某化学兴趣小组用
 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为
您最近半年使用:0次
名校
5 . 氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。请回答下列问题。
(1)下列属于氮的固定的是________ 。
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为_____________ 。
(3)三氟化氮( )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。
①写出该反应的化学方程式:___________ ,反应中生成0.2 mol  ,转移的电子数目为
,转移的电子数目为___________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
② 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是___________ 。
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途______ 。
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是_________________ (填“正盐”或“酸式盐”)。
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为_____________ 。
(1)下列属于氮的固定的是
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为
(3)三氟化氮(
 )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。①写出该反应的化学方程式:
 ,转移的电子数目为
,转移的电子数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②
 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
您最近半年使用:0次
名校
6 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生Na2O、N2和O2,其水溶液呈碱性,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___NO +___I-+___=___NO↑+___I2+___H2O。
+___I-+___=___NO↑+___I2+___H2O。
(1)请完成该离子方程式并配平___________ 。
(2)从物质分类角度来看,NaNO2是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是___________ 。从环保角度来讲,要将NaNO2转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体NaNO2和NaCl的是___________(填序号)。
(5)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列___________ (填序号)反应中H2O2表现出的性质相同。
A.2H2O2 2H2O+O2↑
2H2O+O2↑
B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
___NO
 +___I-+___=___NO↑+___I2+___H2O。
+___I-+___=___NO↑+___I2+___H2O。(1)请完成该离子方程式并配平
(2)从物质分类角度来看,NaNO2是
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
(4)下列方法不能用来区分固体NaNO2和NaCl的是___________(填序号)。
| A.分别溶于水,滴加酚酞试液 | B.分别溶于水并滴加HNO3酸化的AgNO3溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
A.2H2O2
 2H2O+O2↑
2H2O+O2↑B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
您最近半年使用:0次
名校
7 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
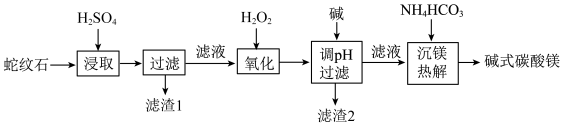
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
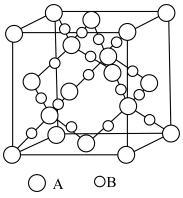
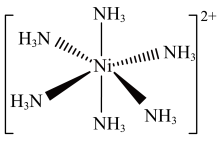
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近半年使用:0次
2024-02-11更新
|
221次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高三上学期高考适应性月考卷(六)理科综合试卷
8 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近半年使用:0次
9 . 一种以赤铁矿(主要含有Fe2O3,含少量Al2O3、CaO等)为原料制备高纯度铁红的流程如下:
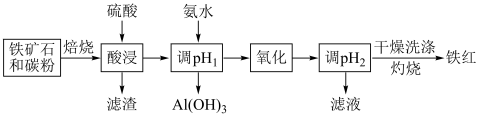
回答下列问题:
(1)“酸浸”时,Al2O3发生反应的离子方程式是___________ 。
(2)“酸浸”后的实验操作名称是___________ ,滤渣的主要成分是___________ 。
(3)“调pH1”不能用氢氧化钠溶液代替氨水的原因是___________ 。
(4)“氧化”时可选用多种氧化剂,若选择氯水,反应的离子方程式为___________ 。
(5)“氧化”后如何检验氧化产物,操作步骤是___________ 。
(6)灼烧时发生反应的化学方程式为___________ 。
(7)写出铁红在生产生活中的一种用途___________ 。

回答下列问题:
(1)“酸浸”时,Al2O3发生反应的离子方程式是
(2)“酸浸”后的实验操作名称是
(3)“调pH1”不能用氢氧化钠溶液代替氨水的原因是
(4)“氧化”时可选用多种氧化剂,若选择氯水,反应的离子方程式为
(5)“氧化”后如何检验氧化产物,操作步骤是
(6)灼烧时发生反应的化学方程式为
(7)写出铁红在生产生活中的一种用途
您最近半年使用:0次
10 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
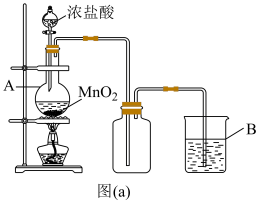
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
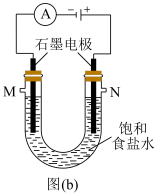
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
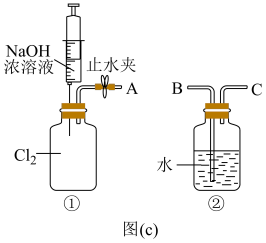
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近半年使用:0次



