名校
1 . 非金属元素在化工生产中扮演着重要的角色。在众多的化工原料和产品中,都能见到硫和氮等元素的踪迹。
Ⅰ.利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______。
(3)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。
Ⅱ.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
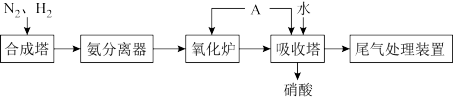
(4)写出氧化炉中的化学反应方程式_______ 。
(5)向吸收塔中通入A的作用_______ 。
(6)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用_______ (填化学式)溶液吸收。
(7)取一定量制取的硝酸加水稀释到50mL,加入过量的铜充分反应,再向溶液中加入足量的稀硫酸,最终共收集到6.72L(标况)NO、NO2的混合气体(不考虑N2O4),铜仍有剩余,将气体充入0.125molO2并倒扣于水槽中,水刚好充满整支试管,则原稀释后的硝酸的物质的量浓度是_______ mol/L,反应溶解的铜有_______ g。
Ⅰ.利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______。
| A.H2S溶液 | B.CaCl2溶液 |
| C.H2O2溶液 | D.饱和Na2CO3溶液 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:Ⅱ.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(4)写出氧化炉中的化学反应方程式
(5)向吸收塔中通入A的作用
(6)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用
(7)取一定量制取的硝酸加水稀释到50mL,加入过量的铜充分反应,再向溶液中加入足量的稀硫酸,最终共收集到6.72L(标况)NO、NO2的混合气体(不考虑N2O4),铜仍有剩余,将气体充入0.125molO2并倒扣于水槽中,水刚好充满整支试管,则原稀释后的硝酸的物质的量浓度是
您最近半年使用:0次
解题方法
2 . 下列古诗或古文中的描述与化学方程式对应关系不正确的是
A.丹砂烧之成水银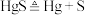 |
B.爆竹声中一岁除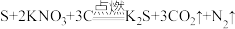 |
C.炉火照天地红星乱紫烟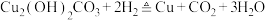 |
D.曾青得铁化为铜 |
您最近半年使用:0次
解题方法
3 . Ⅰ.硫元素是动植物生长不可缺少的元素,下图是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
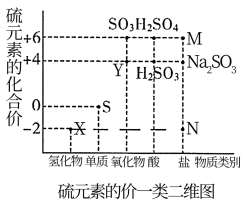
(1)图中X对应的物质是___________ ,将X气体通入 溶液中会出现淡黄色沉淀,反应物
溶液中会出现淡黄色沉淀,反应物 作
作___________ 剂(填“氧化”或“还原”)。
(2)空气中易造成硫酸酸雨的主要气体是___________ (填化学式);
(3)请写出铜和浓硫酸反应的化学方程式___________ 。
Ⅱ.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
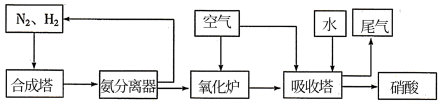
(1)氧化炉中, 转化为NO的化学方程式为
转化为NO的化学方程式为___________ 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的___________ 性质。
(3)写出硝酸的电离方程式___________ 。
(4)吸收塔中出来的尾气可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:
a.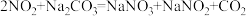
b.
根据反应b,每产生11.2L(标准状况下) ,吸收液质量将增加
,吸收液质量将增加___________ g。

(1)图中X对应的物质是
 溶液中会出现淡黄色沉淀,反应物
溶液中会出现淡黄色沉淀,反应物 作
作(2)空气中易造成硫酸酸雨的主要气体是
(3)请写出铜和浓硫酸反应的化学方程式
Ⅱ.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(1)氧化炉中,
 转化为NO的化学方程式为
转化为NO的化学方程式为(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的
(3)写出硝酸的电离方程式
(4)吸收塔中出来的尾气可用
 溶液吸收,主要反应为:
溶液吸收,主要反应为:a.
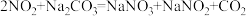
b.

根据反应b,每产生11.2L(标准状况下)
 ,吸收液质量将增加
,吸收液质量将增加
您最近半年使用:0次
4 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
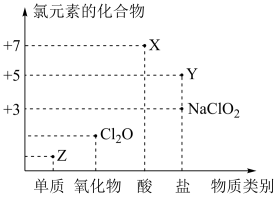
回答下列问题:
(1)X是强氧化剂。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸危险。已知X与硫反应可产生两种强酸,试写出相应化学反应方程式为___________ 。
(2)氯的某种氧化物(C1mOn)中氯、氧元素质量比为71∶48,则m∶n=___________ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为___________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为 ,消毒效率以单位物质的量得到的电子数表示)。
,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为___________ 。

回答下列问题:
(1)X是强氧化剂。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸危险。已知X与硫反应可产生两种强酸,试写出相应化学反应方程式为
(2)氯的某种氧化物(C1mOn)中氯、氧元素质量比为71∶48,则m∶n=
(3)Y可用于实验室制O2,其焰色试验为紫色,Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,生成的两种盐的化学式分别为
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
 ,消毒效率以单位物质的量得到的电子数表示)。
,消毒效率以单位物质的量得到的电子数表示)。(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近半年使用:0次
5 . 硫元素和氨元素在化学实验、化工生产中扮演着重要角色。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
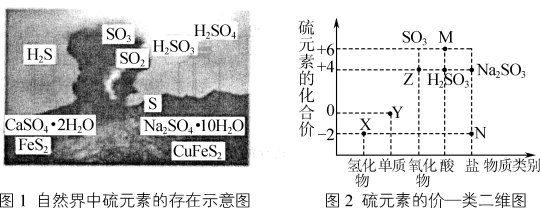
(1)图2中N所对应图1中物质的化学式为_______ ,Y与金属铜反应所得产物的化学式为_______ 。X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)碳和M的浓溶液反应生成Z的化学方程式为_______ 。
(3)从分类角度分析判断,下列物质不属于酸性氧化物的是_______。
II.氮及其化合物在很多方面有广泛应用。
(4)实验室常用 与
与 制取氨气。证明氨气已集满的操作和现象是
制取氨气。证明氨气已集满的操作和现象是_______ 。
(5)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
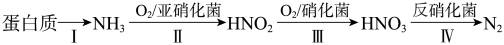
请回答:
①根据下图判断,使用亚硝化菌的最佳条件为_______ 。
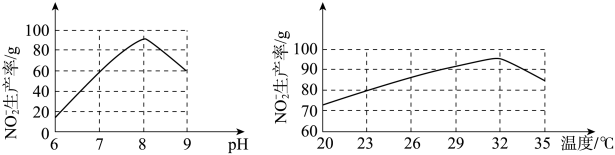
②利用微生物处理含氮废水的优点为_______ 。(答出2点即可)。
(6)汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式_______ 。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

(1)图2中N所对应图1中物质的化学式为
(2)碳和M的浓溶液反应生成Z的化学方程式为
(3)从分类角度分析判断,下列物质不属于酸性氧化物的是_______。
A. | B. | C. | D. |
II.氮及其化合物在很多方面有广泛应用。
(4)实验室常用
 与
与 制取氨气。证明氨气已集满的操作和现象是
制取氨气。证明氨气已集满的操作和现象是(5)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
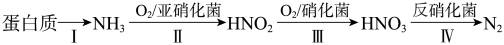
请回答:
①根据下图判断,使用亚硝化菌的最佳条件为

②利用微生物处理含氮废水的优点为
(6)汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式
您最近半年使用:0次
名校
6 . “价-类”二维图是预测物质性质的重要思维工具。如图是硫元素的常见化合价与部分物质类别的对应关系:
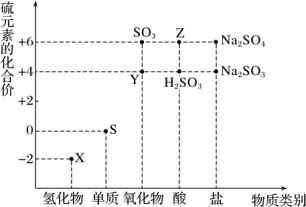
(1)图中X、Y、Z三种物质中,属于非电解质的是___________ (用化学式表示)。
(2)Z的浓溶液可用铝质容器储存的原因是___________ 。
(3)工业上用黄铁矿(主要成分 )在高温下制取
)在高温下制取 的主要反应的化学方程式为
的主要反应的化学方程式为___________ 。
(4)请设计一个Z转化为Y的路径___________ (用化学方程式表示)。
(5)硫代硫酸钠 商品名“海波”,俗名“大苏打”。
商品名“海波”,俗名“大苏打”。
①从类别的角度分析,其属于___________ (填标号)。
A.盐 B.碱 C.酸 D.氧化物
从价态的角度分析,
___________ (填标号)
A.只有氧化性 B.既有氧化性又有还原性 C.只有还原性
②淼同学在实验室配制 (易溶于水)溶液,向新制氯水中滴入少量
(易溶于水)溶液,向新制氯水中滴入少量 溶液,氯水褪色,反应生成
溶液,氯水褪色,反应生成 ,用离子方程式帮助他解释现象
,用离子方程式帮助他解释现象___________

(1)图中X、Y、Z三种物质中,属于非电解质的是
(2)Z的浓溶液可用铝质容器储存的原因是
(3)工业上用黄铁矿(主要成分
 )在高温下制取
)在高温下制取 的主要反应的化学方程式为
的主要反应的化学方程式为(4)请设计一个Z转化为Y的路径
(5)硫代硫酸钠
 商品名“海波”,俗名“大苏打”。
商品名“海波”,俗名“大苏打”。①从类别的角度分析,其属于
A.盐 B.碱 C.酸 D.氧化物
从价态的角度分析,

A.只有氧化性 B.既有氧化性又有还原性 C.只有还原性
②淼同学在实验室配制
 (易溶于水)溶液,向新制氯水中滴入少量
(易溶于水)溶液,向新制氯水中滴入少量 溶液,氯水褪色,反应生成
溶液,氯水褪色,反应生成 ,用离子方程式帮助他解释现象
,用离子方程式帮助他解释现象
您最近半年使用:0次
解题方法
7 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
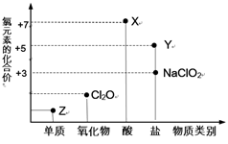
回答下列问题:
(1)X的电离方程式为______ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为______ 。
(4)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为______ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为
(4)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近半年使用:0次
解题方法
8 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
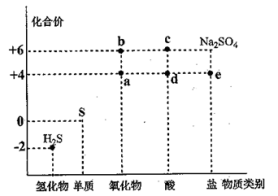
(1)质量相同的 和
和 ,物质的量之比为
,物质的量之比为___________ 。
(2) 的浓溶液能与
的浓溶液能与 反应产生一种气体,该气体的化学式为
反应产生一种气体,该气体的化学式为___________ 。
(3)将足量的 通入
通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是___________ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理: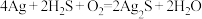 。
。 在该反应中
在该反应中___________ (填标号)。
A.是氧化剂 B.是还原剂 C.既是氧化剂也是还原剂 D.既不是氧化剂也不是还原剂
(5)已知 为正盐,且能被酸性
为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________ 。

(1)质量相同的
 和
和 ,物质的量之比为
,物质的量之比为(2)
 的浓溶液能与
的浓溶液能与 反应产生一种气体,该气体的化学式为
反应产生一种气体,该气体的化学式为(3)将足量的
 通入
通入 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 或
或 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:
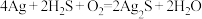 。
。 在该反应中
在该反应中A.是氧化剂 B.是还原剂 C.既是氧化剂也是还原剂 D.既不是氧化剂也不是还原剂
(5)已知
 为正盐,且能被酸性
为正盐,且能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:
您最近半年使用:0次
2021-02-05更新
|
578次组卷
|
3卷引用:山东省济南市2020-2021学年高一上学期学情诊断考试化学试题
山东省济南市2020-2021学年高一上学期学情诊断考试化学试题(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)山东省高密市第三中学(创新学院)2022-2023学年高一上学期开学检测化学试题
名校
解题方法
9 . 某铬盐厂净化含Cr(VI)废水并提取Cr2O3的一种工艺流程如下图所示。
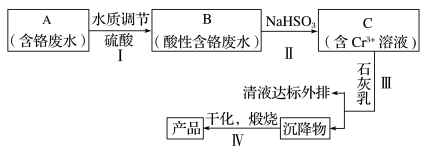
已知:Ksp[Cr(OH)3]=6.3×10-31 Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17
(1)步聚I中,发生的反应为:2H++2CrO42-⇌Cr2O72-+H2O,B中含铬元素的离子有___ (填离子符号).
(2)产品中除Cr2O3外还含有的主要杂质是_______ 。
(3)若测得清液pH=5,此时Cr3+的浓度=_____ mol/L。
(4)当清液中Cr3+的浓度≤1.5mg•L-1时,可认为已达铬的排放标准,上述清液是否符合铬的排放标准_______ (填“是”或“否”)
(5)步骤Ⅱ还可以用其他物质代替NaHSO3作还原剂.
①若用FeSO4•7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有___ (填离子符号).
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c( )的对应关系如下表所示。
)的对应关系如下表所示。
有人认为pH=6时,c( )变小的原因是
)变小的原因是 基本上都已转化为Cr3+.这种说法是否正确,为什么?
基本上都已转化为Cr3+.这种说法是否正确,为什么?
答:_________________________________________________________________ .
③用足量铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___ .

已知:Ksp[Cr(OH)3]=6.3×10-31 Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17
(1)步聚I中,发生的反应为:2H++2CrO42-⇌Cr2O72-+H2O,B中含铬元素的离子有
(2)产品中除Cr2O3外还含有的主要杂质是
(3)若测得清液pH=5,此时Cr3+的浓度=
(4)当清液中Cr3+的浓度≤1.5mg•L-1时,可认为已达铬的排放标准,上述清液是否符合铬的排放标准
(5)步骤Ⅱ还可以用其他物质代替NaHSO3作还原剂.
①若用FeSO4•7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(
 )的对应关系如下表所示。
)的对应关系如下表所示。| pH | 3 | 4 | 5 | 6 |
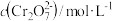 | 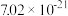 | 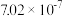 |  | 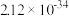 |
有人认为pH=6时,c(
 )变小的原因是
)变小的原因是 基本上都已转化为Cr3+.这种说法是否正确,为什么?
基本上都已转化为Cr3+.这种说法是否正确,为什么?答:
③用足量铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有
您最近半年使用:0次
名校
10 . Ⅰ.如图是氮元素的各种价态与物质类别的对应关系:
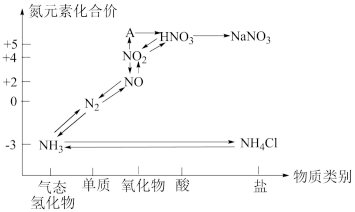
(1)根据A对应的化合价和物质类别,A为___________ (写分子式,下同),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式:___________ 。
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)
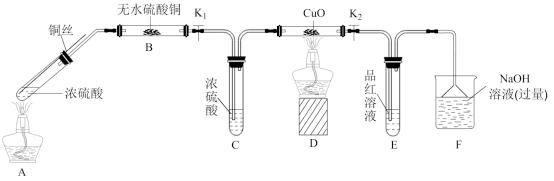
(1)B装置中的现象是___________ 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是___________ 。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是___________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀HNO3的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
Ⅱ.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。(固定装置已略去)

(1)B装置中的现象是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
您最近半年使用:0次



