名校
1 . 碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了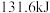 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算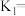
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a. b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到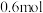 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了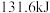 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
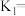
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到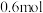 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近一年使用:0次
23-24高三上·北京·阶段练习
2 . 近年来,碳中和、碳达峰成为热点。工业上可利用 来制备多种物质。
来制备多种物质。
Ⅰ. 和
和 可制备甲醇,过程中可发生以下反应:
可制备甲醇,过程中可发生以下反应:
反应a:
反应b:生成 和
和 的副反应。
的副反应。
已知:
___________ 。
(2)将 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放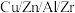 催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
已知: 产率
产率
①催化剂活性最好的温度为___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
②温度由 升到
升到 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:___________ 。
(3) 的平衡转化率(X-CO2)、
的平衡转化率(X-CO2)、 的选择性(S-CH3OH)随温度、压强变化如下:
的选择性(S-CH3OH)随温度、压强变化如下: 。
。
①请判断p1、p2的大小关系并说明理由:___________ 。
② 左右,体系发生的反应主要是
左右,体系发生的反应主要是___________ 。
③初始 ,平衡后
,平衡后 、
、 ,若只发生a、b,则
,若只发生a、b,则 的平衡转化率为
的平衡转化率为___________ 。
Ⅱ.我国科学家采用单原子 和纳米作串联催化剂,通过电解法将
和纳米作串联催化剂,通过电解法将 转化为乙烯。装置示意图如图。
转化为乙烯。装置示意图如图。
已知:电解效率 。
。 催化剂上发生的反应:
催化剂上发生的反应:___________ 。
(5)若乙烯的电解效率为60%,电路中通过 电子时,产生乙烯
电子时,产生乙烯___________  。
。
 来制备多种物质。
来制备多种物质。Ⅰ.
 和
和 可制备甲醇,过程中可发生以下反应:
可制备甲醇,过程中可发生以下反应:反应a:

反应b:生成
 和
和 的副反应。
的副反应。已知:


(2)将
 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放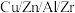 催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。已知:
 产率
产率
①催化剂活性最好的温度为
a.
 b.
b. c.
c. d.
d.
②温度由
 升到
升到 的平衡转化率和
的平衡转化率和 的实验产率均降低,解释原因:
的实验产率均降低,解释原因:(3)
 的平衡转化率(X-CO2)、
的平衡转化率(X-CO2)、 的选择性(S-CH3OH)随温度、压强变化如下:
的选择性(S-CH3OH)随温度、压强变化如下:
 。
。①请判断p1、p2的大小关系并说明理由:
②
 左右,体系发生的反应主要是
左右,体系发生的反应主要是③初始
 ,平衡后
,平衡后 、
、 ,若只发生a、b,则
,若只发生a、b,则 的平衡转化率为
的平衡转化率为Ⅱ.我国科学家采用单原子
 和纳米作串联催化剂,通过电解法将
和纳米作串联催化剂,通过电解法将 转化为乙烯。装置示意图如图。
转化为乙烯。装置示意图如图。已知:电解效率
 。
。
 催化剂上发生的反应:
催化剂上发生的反应:(5)若乙烯的电解效率为60%,电路中通过
 电子时,产生乙烯
电子时,产生乙烯 。
。
您最近一年使用:0次
3 . 下列说法或表示方法正确的是
| A.葡萄糖在体内发生氧化反应,吸收能量 |
B.化学反应的 ,只与反应体系的始态和终态有关,与反应途径无关 ,只与反应体系的始态和终态有关,与反应途径无关 |
C.在25℃和101kPa时,  , , 的燃烧热为 的燃烧热为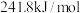 |
D.在稀溶液中,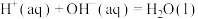  ,若将含 ,若将含 的稀溶液与含 的稀溶液与含 的稀溶液混合,放出的热量等于 的稀溶液混合,放出的热量等于 |
您最近一年使用:0次
4 . 25℃、101kPa下,①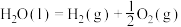
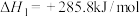
②
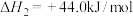
下列说法不正确 的是
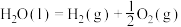
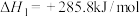
②

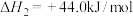
下列说法
| A.液态水变为水蒸气是物理变化 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下,22.4L水中含原子总数约为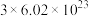 |
D.25℃、101kPa下, 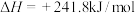 |
您最近一年使用:0次
2023-12-18更新
|
64次组卷
|
2卷引用:北京市广渠门中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 工业上利用 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: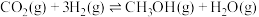
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
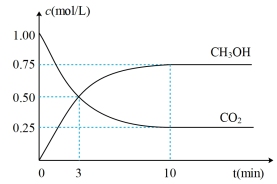
(1)达到平衡的时刻是_______ min(填“3”或“10”)。在前10min内,用 浓度的变化表示的反应速率
浓度的变化表示的反应速率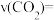
_______ mol/(L•min)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)达平衡后, 的转化率是
的转化率是_______ 。平衡常数K=_______ (计算结果保留一位小数)。
(4)工业上也可用CO和 合成甲醇
合成甲醇
已知:①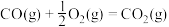

②

③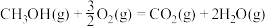

则反应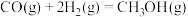

_______ kJ/mol
 和
和 反应生成甲醇,也是减少
反应生成甲醇,也是减少 的一种方法。在容积为1L的恒温密闭容器中充入
的一种方法。在容积为1L的恒温密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: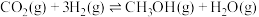
 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
(1)达到平衡的时刻是
 浓度的变化表示的反应速率
浓度的变化表示的反应速率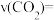
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不变 | B.混合气体中 不变 不变 |
C. | D.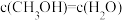 |
(3)达平衡后,
 的转化率是
的转化率是(4)工业上也可用CO和
 合成甲醇
合成甲醇已知:①
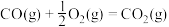

②


③
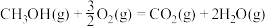

则反应
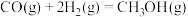

您最近一年使用:0次
名校
6 . 碳氧化物、氮氧化物处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的 ,有利于减少
,有利于减少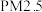 的排放。
的排放。
已知:I.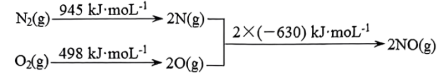
Ⅱ.

①
___________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式
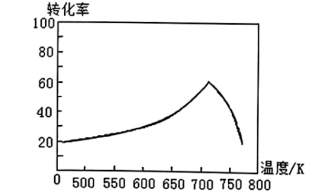
转化为无毒气体,写出反应的热化学方程式___________ 。一定条件下,单位时间内不同温度下测定的氮氧化物转化率如下图所示。温度高于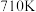 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是___________ 。
(2)消除燃煤烟气中的 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是___________ 。
 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:
i. ,
,
ⅱ. ,
,
 转化为
转化为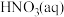 的热化学方程式是
的热化学方程式是___________ 。
研究 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:
 影响
影响 脱除率的原因是
脱除率的原因是___________ 。
(1)消除汽车尾气中的
 ,有利于减少
,有利于减少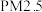 的排放。
的排放。已知:I.

Ⅱ.


①

②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式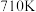 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是
(2)消除燃煤烟气中的
 (主要成分为
(主要成分为 、
、 的混合物)可以采用
的混合物)可以采用 溶液吸收脱除。
溶液吸收脱除。 水解的离子方程式是
水解的离子方程式是 溶液吸收
溶液吸收 的主要过程如下:
的主要过程如下:i.
 ,
,ⅱ.
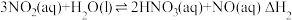 ,
,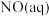 转化为
转化为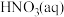 的热化学方程式是
的热化学方程式是研究
 对
对 脱除率的影响。调节
脱除率的影响。调节 溶液的初始
溶液的初始 ,
, 的脱除率如下:
的脱除率如下:初始 | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
 脱除率 脱除率 | 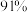 |  |  |  | 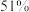 |
 影响
影响 脱除率的原因是
脱除率的原因是
您最近一年使用:0次
名校
解题方法
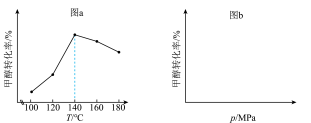
7 .  是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
I.合成甲醇
在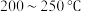 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:
反应i
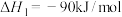
反应ii
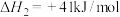
反应iii

(1)
______ KJ/mol。
(2)同时也存在副反应iv: ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因______ 。(已知 的沸点为
的沸点为 的沸点为
的沸点为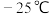 )
)
Ⅱ.甲醇的综合利用:以 和甲醇为原料直接合成碳酸二甲酯
和甲醇为原料直接合成碳酸二甲酯 。
。
反应v
(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
①反应 的
的
______ 0(填“>”或“<”)。
②在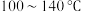 之间,随着温度升高,甲醇转化率增大的原因是
之间,随着温度升高,甲醇转化率增大的原因是______ 。
③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)______ 。
 是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。I.合成甲醇

在
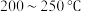 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:反应i

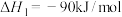
反应ii

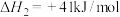
反应iii


(1)

(2)同时也存在副反应iv:
 ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因 的沸点为
的沸点为 的沸点为
的沸点为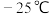 )
)Ⅱ.甲醇的综合利用:以
 和甲醇为原料直接合成碳酸二甲酯
和甲醇为原料直接合成碳酸二甲酯 。
。反应v

(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
①反应
 的
的
②在
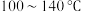 之间,随着温度升高,甲醇转化率增大的原因是
之间,随着温度升高,甲醇转化率增大的原因是③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)

您最近一年使用:0次
8 . 工业中可用碘硫循环法处理 气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
已知: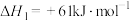

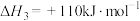

 气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是已知:
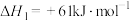

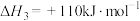

A.反应物B是 |
B.反应①方程式为 |
C.等压条件下,反应①②③反应热之和小于 直接分解的反应热 直接分解的反应热 |
D.碘硫循环法总反应热化学方程式为 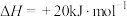 |
您最近一年使用:0次
名校
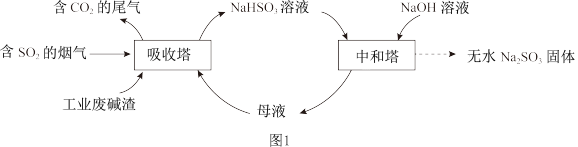
9 . 直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
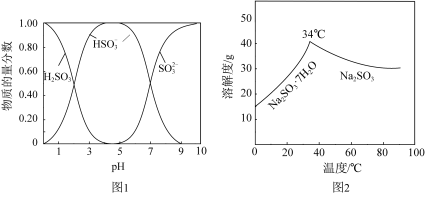
已知:H2SO3、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_______ 。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_______ 。
②NaHSO3溶液中c(SO )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:_______ 。
③已知下列反应:
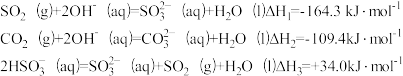
吸收塔中Na2CO3溶液吸收SO2生成HSO 的热化学方程式是
的热化学方程式是_______ 。
④吸收塔中的温度不宜过高,可能的原因是_______ (写出1种即可)。

已知:H2SO3、HSO
 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为
②NaHSO3溶液中c(SO
 )>c(H2SO3),结合方程式解释其原因:
)>c(H2SO3),结合方程式解释其原因:③已知下列反应:
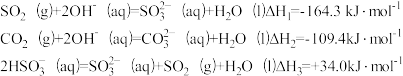
吸收塔中Na2CO3溶液吸收SO2生成HSO
 的热化学方程式是
的热化学方程式是④吸收塔中的温度不宜过高,可能的原因是
您最近一年使用:0次
名校
解题方法
10 . 将 清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
I.利用 合成甲醇
合成甲醇
在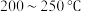 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:
反应i: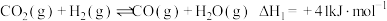
反应ii:
反应iii: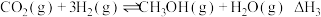
(1)反应ⅲ的焓变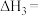
___________  ;反应iii能自发进行的温度条件是
;反应iii能自发进行的温度条件是___________ (填“高温”或“低温”或“任何温度”)。
(2)该反应条件下,同时存在副反应ⅳ: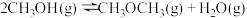 。已知:
。已知: 的沸点为
的沸点为 ,
, 的沸点为
的沸点为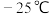 。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因
。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因___________ 。
II.利用 和甲醇合成碳酸二甲酯
和甲醇合成碳酸二甲酯
反应v: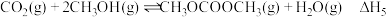
(3)在不同的温度、压强下,一定反应时间内,测定反应ⅴ中甲醇的转化率。甲醇转化率与温度的关系为图a,与压强的关系为图b(曲线未画出)。
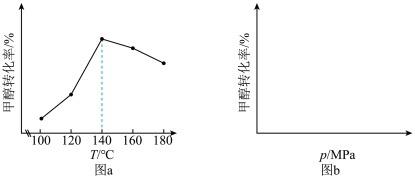
①根据图a判断,反应ⅴ的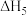
___________ 0(填“>”或“<”)。
②在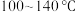 之间,随着温度升高,甲醇转化率增大的原因可能是
之间,随着温度升高,甲醇转化率增大的原因可能是___________ 。
③在图b中绘制出甲醇转化率与压强的关系曲线___________ (表示出变化趋势即可)。
 清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。I.利用
 合成甲醇
合成甲醇
在
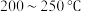 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:反应i:
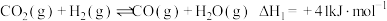
反应ii:

反应iii:
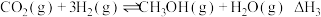
(1)反应ⅲ的焓变
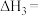
 ;反应iii能自发进行的温度条件是
;反应iii能自发进行的温度条件是(2)该反应条件下,同时存在副反应ⅳ:
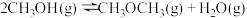 。已知:
。已知: 的沸点为
的沸点为 ,
, 的沸点为
的沸点为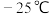 。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因
。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因II.利用
 和甲醇合成碳酸二甲酯
和甲醇合成碳酸二甲酯
反应v:
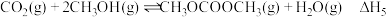
(3)在不同的温度、压强下,一定反应时间内,测定反应ⅴ中甲醇的转化率。甲醇转化率与温度的关系为图a,与压强的关系为图b(曲线未画出)。

①根据图a判断,反应ⅴ的
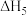
②在
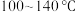 之间,随着温度升高,甲醇转化率增大的原因可能是
之间,随着温度升高,甲醇转化率增大的原因可能是③在图b中绘制出甲醇转化率与压强的关系曲线
您最近一年使用:0次



