解题方法
1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。 资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ:

反应Ⅱ: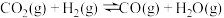
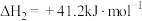
反应Ⅲ:
向恒压、密闭容器中通入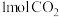 和
和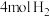 ,平衡时体系内
,平衡时体系内 、
、 、
、 的物质的量(n)与温度(T)的变化关系如图所示。
的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应Ⅰ~Ⅲ中,属于吸热反应的是___________ (填反应序号)。
(2)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算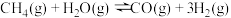 的
的
___________ 。
(3)结合上述反应,解释图中 的物质的量随温度升高而增大的原因:
的物质的量随温度升高而增大的原因:___________ 。
(4)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:___________ 、___________ 。
 资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:反应Ⅰ:


反应Ⅱ:
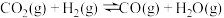
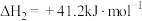
反应Ⅲ:

向恒压、密闭容器中通入
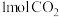 和
和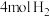 ,平衡时体系内
,平衡时体系内 、
、 、
、 的物质的量(n)与温度(T)的变化关系如图所示。
的物质的量(n)与温度(T)的变化关系如图所示。
(1)反应Ⅰ~Ⅲ中,属于吸热反应的是
(2)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算
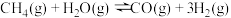 的
的
(3)结合上述反应,解释图中
 的物质的量随温度升高而增大的原因:
的物质的量随温度升高而增大的原因:(4)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:
您最近一年使用:0次
名校
解题方法
2 . 煤炭综合利用方法如下
(1)煤气化制氢气过程
反应I: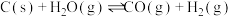
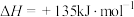
反应Ⅱ:
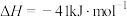 。
。
①计算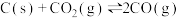

_____ kJ/mol
②反应I通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:_____ 。
③在煤气化制氢气过程中增大H2O(g)气流流速,提高其浓度,下列一定增大的是_____ 。
A.H2O(g)的转化率
B.出口气中H2的物质的量
C.单位时间内H2O(g)的消耗量
(2)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
反应A.
反应B.
①反应A平衡常数表达式为_____ 。
②某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,原因是_____ 。
(1)煤气化制氢气过程
反应I:
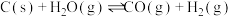
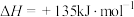
反应Ⅱ:

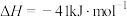 。
。①计算
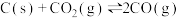

②反应I通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:
③在煤气化制氢气过程中增大H2O(g)气流流速,提高其浓度,下列一定增大的是
A.H2O(g)的转化率
B.出口气中H2的物质的量
C.单位时间内H2O(g)的消耗量
(2)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
反应A.

反应B.

①反应A平衡常数表达式为
②某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
| T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,原因是
您最近一年使用:0次
3 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I.甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为___________ 。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) = CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是___________ 。
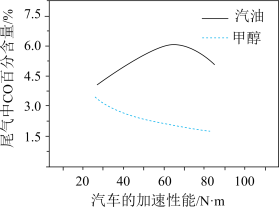
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如下图所示。根据下图信息分析,与汽油相比,甲醇作为燃料的优点是___________ 。
II.甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
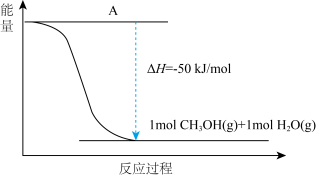
①补全上图:图中A处应填入___________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH___________ 。(填“变大”“变小”或“不变”)
(5)为了合成甲醇反应:CO(g) + 2H2(g) = CH3OH(g) ΔH =-91kJ/mol
已知:i.CO(g)+1/2 O2(g) = CO2(g) Δ H1=-283 kJ/mol
ii. ∙∙∙∙∙∙ ΔH2
iii.CH3OH(g) + 3/2 O2(g) = CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
还需要利用反应ii,请写出该反应的热化学反应方程式_______________________ 。
(6)用稀硫酸作电解质溶液,电解CO2也可制取CH3OH,装置如下图所示,电极b为电解池的___________ 极(填“阴”或“阳”),生成 的电极反应式是
的电极反应式是___________ 。

I.甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) = CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如下图所示。根据下图信息分析,与汽油相比,甲醇作为燃料的优点是

II.甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(5)为了合成甲醇反应:CO(g) + 2H2(g) = CH3OH(g) ΔH =-91kJ/mol
已知:i.CO(g)+1/2 O2(g) = CO2(g) Δ H1=-283 kJ/mol
ii. ∙∙∙∙∙∙ ΔH2
iii.CH3OH(g) + 3/2 O2(g) = CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
还需要利用反应ii,请写出该反应的热化学反应方程式
(6)用稀硫酸作电解质溶液,电解CO2也可制取CH3OH,装置如下图所示,电极b为电解池的
 的电极反应式是
的电极反应式是
您最近一年使用:0次
名校
解题方法
4 . “碳达峰-碳中和”是我国社会发展重大战略之一
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A: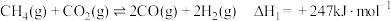
反应B:
(1)反应 的 △H=
的 △H=___________ kJ/mol。
(2)恒压、750 ℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是___________ (填字母序号)。

a.过程ⅰ和过程ⅱ中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ii,CaO吸收CO2可促使Fe3O4氧化CO的平衡正移
d.相比于反应A,该流程的总反应还原1 mol CO2需要吸收的能量更少
Ⅱ.工业上可用制备CH3OH:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。
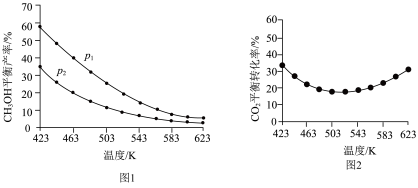
①图1中,压强p1___________ p2(填“>”、“=”或“<”)。
②图2中,压强为p2,温度高于503 K后,CO2平衡转化率随温度升高而增大的原因是___________ 。
(4)实际生产中,测得压强为p3时,相同时间 内不同温度下的CH3OH产率如图3所示。523 K时,CH3OH产率最大,可能的原因是___________ (填字母序号)。
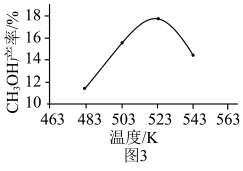
a.此条件下主反应限度最大
b.此条件下主反应速率最快
c.523 K时催化剂的活性最强
Ⅰ.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应A:
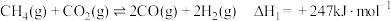
反应B:

(1)反应
 的 △H=
的 △H=(2)恒压、750 ℃时,CH4和CO2按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现CO2高效转化为CO。假设各步均转化完全,下列说法正确的是

a.过程ⅰ和过程ⅱ中均未发生氧化还原反应
b.过程ii中使用的催化剂为Fe和CaCO3
c.过程ii,CaO吸收CO2可促使Fe3O4氧化CO的平衡正移
d.相比于反应A,该流程的总反应还原1 mol CO2需要吸收的能量更少
Ⅱ.工业上可用制备CH3OH:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H。(已知:在制备过程中存在副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。
CO(g)+H2O(g) △H=+41 kJ/mol),将反应气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂,发生反应。(3)不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2所示。

①图1中,压强p1
②图2中,压强为p2,温度高于503 K后,CO2平衡转化率随温度升高而增大的原因是
(4)实际生产中,测得压强为p3时,

a.此条件下主反应限度最大
b.此条件下主反应速率最快
c.523 K时催化剂的活性最强
您最近一年使用:0次
2023-11-04更新
|
164次组卷
|
2卷引用:北京市第一○一中学2023-2024学年高二上学期期中练习化学试题
解题方法
5 . 研究CO2的回收和综合利用对航天建设有重要意义。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于___________ (填“吸热”或“放热”)反应。
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=___________ 。
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:
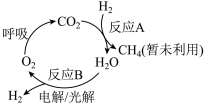
(3)反应A为CO2(g)+4H2(g) CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =___________ kJ·mol−1
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
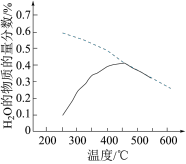
①理论上,能提高CO2平衡转化率的措施有___________ (写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是___________ 。
(5)下列关于空间站内物质和能量变化的说法中,不正确 的是___________ (填字母)。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g) C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:

(3)反应A为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高CO2平衡转化率的措施有
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是
(5)下列关于空间站内物质和能量变化的说法中,
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g)
 C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
您最近一年使用:0次
6 .  加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成
加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成 为例,该转化分为两步进行:
为例,该转化分为两步进行:
第一步: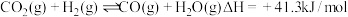
第二步: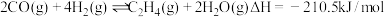
(1)第一步反应的平衡常数表达式
_____ 。
(2) 加氢合成乙烯的热化学方程式是
加氢合成乙烯的热化学方程式是_____ 。
(3)一定条件下的密闭容器中,总反应达到平衡,要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是_____ (填字母)。
a.低压 b.增大 浓度 c.加入适当催化剂 d.分离出水
浓度 c.加入适当催化剂 d.分离出水
(4)下图是其他条件一定时,反应温度对 平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约
平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约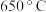 时,
时, 的平衡转化率随着温度升高而增大的原因是
的平衡转化率随着温度升高而增大的原因是_____ 。

 加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成
加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成 为例,该转化分为两步进行:
为例,该转化分为两步进行:第一步:
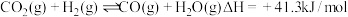
第二步:
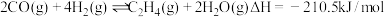
(1)第一步反应的平衡常数表达式

(2)
 加氢合成乙烯的热化学方程式是
加氢合成乙烯的热化学方程式是(3)一定条件下的密闭容器中,总反应达到平衡,要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.低压 b.增大
 浓度 c.加入适当催化剂 d.分离出水
浓度 c.加入适当催化剂 d.分离出水(4)下图是其他条件一定时,反应温度对
 平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约
平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约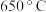 时,
时, 的平衡转化率随着温度升高而增大的原因是
的平衡转化率随着温度升高而增大的原因是
您最近一年使用:0次
7 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应a可实现氯的循环利用:
反应a:
已知:ⅰ.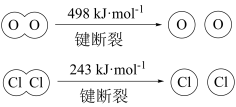
ⅱ.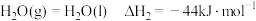
下列说法正确的是
反应a:

已知:ⅰ.

ⅱ.
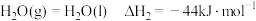
下列说法正确的是
A.反应 的 的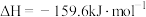 |
| B.反应a中生成物的总能量高于反应物的总能量 |
| C.反应a中涉及极性键、非极性键的断裂和生成 |
D.断开 键比断开 键比断开 键所需吸收的能量高 键所需吸收的能量高 |
您最近一年使用:0次
8 . 已知强酸强碱的稀溶液发生中和反应时,生成 放热
放热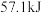 ,若用
,若用 与
与 的稀溶液反应,每
的稀溶液反应,每 完全中和时放热
完全中和时放热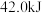 ,下列说法正确的是
,下列说法正确的是
 放热
放热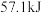 ,若用
,若用 与
与 的稀溶液反应,每
的稀溶液反应,每 完全中和时放热
完全中和时放热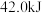 ,下列说法正确的是
,下列说法正确的是A. 是一种强酸 是一种强酸 |
B.浓硫酸与 反应生成 反应生成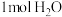 时放热为 时放热为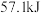 |
C.表示 与 与 中和反应的热化学方程式为: 中和反应的热化学方程式为: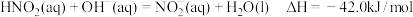 |
D. 电离的热化学方程式为: 电离的热化学方程式为: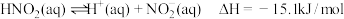 |
您最近一年使用:0次
2023-11-04更新
|
208次组卷
|
3卷引用:北京中国人民大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为
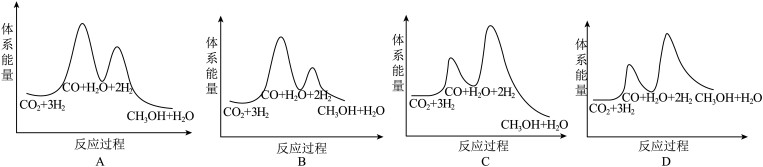
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
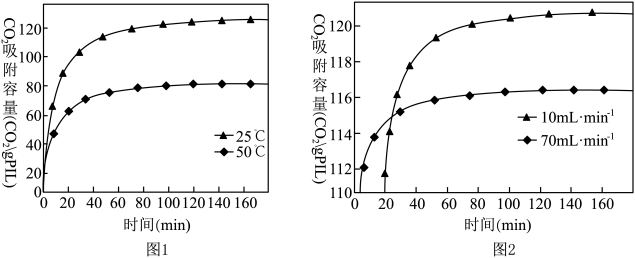
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
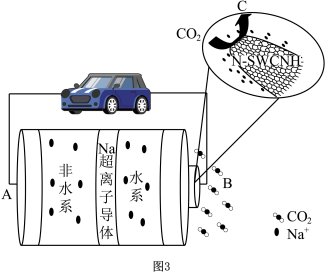
(4)B极的电极反应为
您最近一年使用:0次
名校
解题方法
10 . I.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
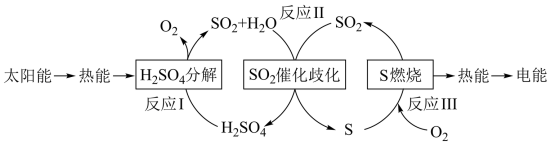
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2___________ p 1(填“>”或“<”),得出该结论的理由是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.________
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是___________ 。
(注:1mmol•L-1=10-3mol•L-1)
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
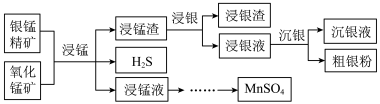
已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:_______
□Fe3+ + Ag2S + □ ___________ □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S
(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.
I2+2H2O+___________=___________+___________+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)一定温度下,反应I2(g)+H2(g)⇌2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11mmol•L-1,c(H2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1.相同度温下,按下列4组初始浓度进行实验,反应逆向进行的是
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
Ⅱ.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
(6)将“浸银”反应的离子方程式补充完整:
□Fe3+ + Ag2S + □ ___________
 □ ___________ + 2[AgCl2]- + S
□ ___________ + 2[AgCl2]- + S(7)结合平衡移动原理,解释浸出剂中Cl-、H+的作用:
您最近一年使用:0次



