名校
解题方法
1 . 化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=_______ kJ/mol。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:_______ 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为_______ (填“吸热”或“放热”)反应。 _______ kJ(用含a、b、c、d的代数式表示)。
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:_______ ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热_______ (填“相等”或“不相等”),原因是_______ 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为_______ 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=_______ kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=
(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。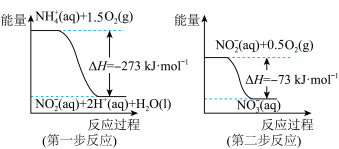
 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为
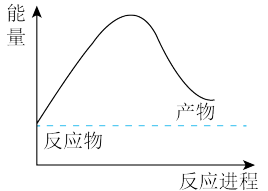
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
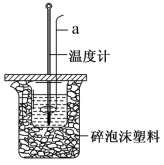
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=
您最近一年使用:0次
2 . 根据所学知识,问答下列问题:
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
___________  。
。
(2)已知: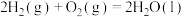
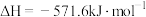 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是___________ 。
(3)一个化学过程的示意图如图。已知甲池的总反应为 。
。

①图中甲池是___________ 装置;A(石墨)电极的名称是___________ 。
②写出通入 的电极的电极反应式:
的电极的电极反应式:___________ 。
③乙池中发生反应的化学方程式为___________ 。当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗___________ mL(标准状况下) 。
。
(1)在25℃、101kPa下,已知完全燃烧4.4g丙烷气体,生成
 和液态水时,释放222.0kJ热量,
和液态水时,释放222.0kJ热量, 的燃烧热
的燃烧热
 。
。(2)已知:
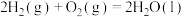
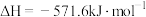 。现有
。现有 和
和 的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中
的混合气体共5mol,完全燃烧时释放3847kJ热量,则在混合气体中 和
和 的体积比是
的体积比是(3)一个化学过程的示意图如图。已知甲池的总反应为
 。
。
①图中甲池是
②写出通入
 的电极的电极反应式:
的电极的电极反应式:③乙池中发生反应的化学方程式为
 。
。
您最近一年使用:0次
2024-03-06更新
|
59次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题
名校
3 . 已知反应① 和反应②
和反应②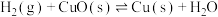 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是
 和反应②
和反应②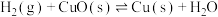 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是A.反应①的平衡常数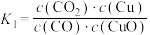 |
B.反应②中,增大氢气浓度,平衡正移, 增大 增大 |
C.对于反应③,T℃时, |
| D.反应③,恒容时,温度升高,K值减小,则该反应为放热反应 |
您最近一年使用:0次
2024-01-07更新
|
177次组卷
|
4卷引用:山西省朔州市怀仁一中2023-2024学年高二上学期12月期中考试化学试题
解题方法
4 . 硫化氢((H₂S))为易燃危化品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
(1)已知:Ⅰ.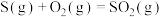
 kJ⋅mol
kJ⋅mol (
( )
)
Ⅱ.
 kJ⋅mol
kJ⋅mol (
( )
)
Ⅲ.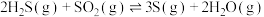
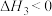
若反应Ⅲ中正反应的活化能为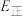 ,逆反应的活化能为
,逆反应的活化能为 ,则
,则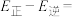
______ (填含a、b的代数式)kJ⋅mol ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是______ (填标号)。
A.体系压强不再变化
B.断裂1 mol 键的同时断裂1 mol
键的同时断裂1 mol  键
键
C.混合气体的密度不再变化
D.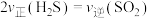
(2)利用工业废气 生产
生产 的反应为
的反应为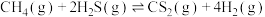 。向某容器中充入1 mol
。向某容器中充入1 mol 、2mol
、2mol 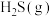 ,体系起始总压强为
,体系起始总压强为 kPa,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图1。
kPa,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图1。
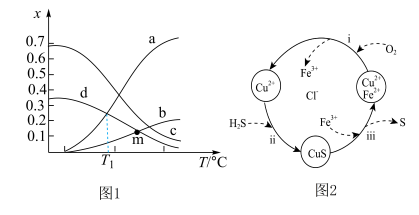
①图中表示 的曲线是
的曲线是______ (填标号)。
② ℃时,该反应的
℃时,该反应的
______ (列出表达式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(3)工业中先将废气与空气混合,再通入 、
、 、
、 的混合液中,其转化过程如图2所示。
的混合液中,其转化过程如图2所示。
已知:25℃时,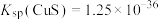 ,
, 的
的 ,
, 。则25℃时过程Ⅱ中的反应
。则25℃时过程Ⅱ中的反应______ (填“能”或“不能”)进行完全。(已知:通常情况下,反应平衡常数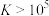 时,认为反应已进行完全)
时,认为反应已进行完全)
(4)某科研小组将微电池技术用于去除废气中的 ,其装置如图3,主要反应:
,其装置如图3,主要反应: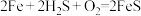
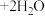 (FeS难溶于水),室温时,
(FeS难溶于水),室温时, 的条件下,研究反应时间对
的条件下,研究反应时间对 的去除率的影响。
的去除率的影响。

①装置中NaCl溶液的作用是______ ,FeS在______ (填“正”或“负”)极生成。
②一段时间后,电流减小,单位时间内 的去除率降低,可能的原因是
的去除率降低,可能的原因是____________ 。
(1)已知:Ⅰ.
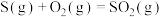
 kJ⋅mol
kJ⋅mol (
( )
)Ⅱ.

 kJ⋅mol
kJ⋅mol (
( )
)Ⅲ.
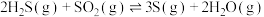
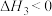
若反应Ⅲ中正反应的活化能为
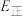 ,逆反应的活化能为
,逆反应的活化能为 ,则
,则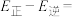
 ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是A.体系压强不再变化
B.断裂1 mol
 键的同时断裂1 mol
键的同时断裂1 mol  键
键C.混合气体的密度不再变化
D.
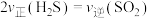
(2)利用工业废气
 生产
生产 的反应为
的反应为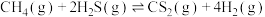 。向某容器中充入1 mol
。向某容器中充入1 mol 、2mol
、2mol 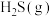 ,体系起始总压强为
,体系起始总压强为 kPa,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图1。
kPa,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图1。
①图中表示
 的曲线是
的曲线是②
 ℃时,该反应的
℃时,该反应的
(3)工业中先将废气与空气混合,再通入
 、
、 、
、 的混合液中,其转化过程如图2所示。
的混合液中,其转化过程如图2所示。已知:25℃时,
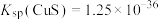 ,
, 的
的 ,
, 。则25℃时过程Ⅱ中的反应
。则25℃时过程Ⅱ中的反应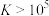 时,认为反应已进行完全)
时,认为反应已进行完全)(4)某科研小组将微电池技术用于去除废气中的
 ,其装置如图3,主要反应:
,其装置如图3,主要反应: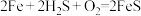
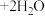 (FeS难溶于水),室温时,
(FeS难溶于水),室温时, 的条件下,研究反应时间对
的条件下,研究反应时间对 的去除率的影响。
的去除率的影响。
图3
①装置中NaCl溶液的作用是
②一段时间后,电流减小,单位时间内
 的去除率降低,可能的原因是
的去除率降低,可能的原因是
您最近一年使用:0次
名校
解题方法
5 . 我国科学家在合成气直接制烯烃方面的研究获重大突破。已知:

下列说法不正确的是

下列说法不正确的是
| A.△H1-△H2<0 |
| B.反应②为吸热反应 |
C.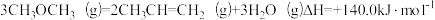 |
D.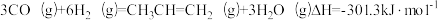 |
您最近一年使用:0次
10-11高一下·辽宁大连·期末
名校
解题方法
6 . 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。下列说法正确的是
已知:①
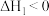
②
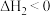
③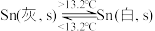
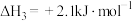
已知:①

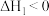
②

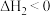
③
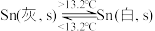
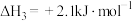
A.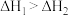 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
D.锡制器皿长期处在低于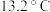 的环境中,会自行毁坏 的环境中,会自行毁坏 |
您最近一年使用:0次
2023-12-18更新
|
110次组卷
|
89卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题
山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷浙江省嘉兴市第一中学2017-2018学年高二上学期期中考试化学试题山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题陕西省安康市2022-2023学年高二上学期11月期中化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题黑龙江省方正县高楞高级中学校2023-2024学年高二上学期期中化学试题河北省石家庄卓越中学2023-2024学年高一下学期期中考试化学试题(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷(已下线)2014-2015学年广东东莞市第七中学高二上学期第一次月考化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷云南省姚安县第一中学2017-2018学年高二10月月考化学试题江西省南康中学2017-2018学年高二上学期第一次月考化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期11月考试化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题【全国校级联考】浙江省金华市十校2017-2018学年高二下学期期末联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题云南省曲靖市会泽县一中2018-2019学年高二上学期第一次半月考化学试题安徽省芜湖市顶峰美术学校2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试福建省泉州第十六中学2019-2020学年高二10月份月考化学试题湖南省长沙市第一中学2019-2020学年高二上学期第一次月考化学试题四川省乐山市2019-2020学年高二上学期期末教学质量检测化学试题海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题吉林省长春市十一高中2020-2021学年高一下学期第三学程考试化学试题(已下线)第一节 化学反应与能量变化 (第2课时 热化学方程式 中和热的测定)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题江西省九江一中2020-2021学年高二上学期月考化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题内蒙古赤峰市第二中学2021-2022学年高二上学期第一次月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题江西省六校2021-2022学年高二上学期期末联考化学试题四川省遂宁市射洪中学校2021—2022学年高二上学期第三次(12月)月考化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题河南省豫西顶级名校2021-2022学年高二下学期4月联考化学试题第二节 反应热的计算 第1课时 盖斯定律(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)1.2 反应热的计算-同步学习必备知识江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题河南省通许县一中2022—2023年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题广东仲元中学2021-2022学年高二上学期开学检测 化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题安徽省马鞍山市第二十二中学2022-2023学年高二上学期阶段检测化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题作业(三) 反应热的计算作业(三) 反应焓变的计算河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题广东省广州市越秀区第七中学2023-2024学年高二上学期10月月考化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期开学化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
7 . 纳米花状催化剂Cu/ZnO可用于催化乙酸甲酯加氢制备乙醇,反应历程如图所示,总反应经历如下两步:
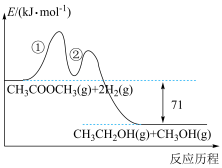
①
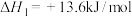
②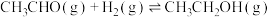

下列说法正确的是

①

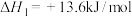
②
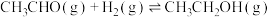

下列说法正确的是
A.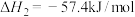 |
| B.反应①决定总反应的速率 |
| C.升高温度,反应①、②的平衡均正向移动 |
D.对于反应①,分离出 时,该反应的正反应增大,逆反应速率减小 时,该反应的正反应增大,逆反应速率减小 |
您最近一年使用:0次
8 . 已知N2O和CO反应进程的相对能量变化如图所示。已知CO(g)的燃烧热ΔH=-283kJ·mol-1。下列说法错误的是
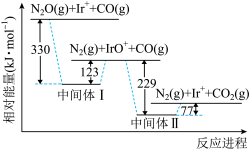

| A.中间体Ⅱ比中间体I稳定 |
| B.Ir+是上述反应的催化剂 |
| C.该反应过程中Ir元素的化合价发生了变化 |
D.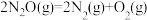 的反应热ΔH为-76kJ·mol-1 的反应热ΔH为-76kJ·mol-1 |
您最近一年使用:0次
9 . 已知: 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式:
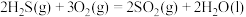
 ①
①

 ②
②

 ③
③
 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是
 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式: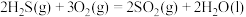
 ①
①
 ②
②
 ③
③ 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是A.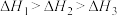 | B.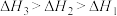 |
C.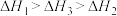 | D.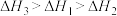 |
您最近一年使用:0次
2023-12-03更新
|
476次组卷
|
24卷引用:山西省怀仁市2021-2022学年高二上学期期中化学试题
山西省怀仁市2021-2022学年高二上学期期中化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期中考试化学试题(理)河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题山东省聊城市2023-2024学年高二上学期11月期中考试化学试题天津市南开区2023-2024学年高二上学期11月期中考试化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)广西钦州市2021-2022学年高二上学期期末考试化学试题第二节 反应热的计算 第2课时 反应热的计算贵州省部分学校2022-2023学年高二上学期10月联考化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题章末检测卷(一) 化学反应的热效应广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题安徽省无为襄安中学2022-2023学年高二下学期开学考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
10 . 我国是世界上最大的PO (环氧丙烷,C3H6O)生产国,环氧丙烷是一种高价值化工中间体,广泛用于化工、农药汽车、纺织等行业。回答下列问题:
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2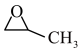 (g),该反应的△H=
(g),该反应的△H=_______ 。【已知:丙烯、环氧丙烷(C3H6O)的燃烧热(△H)分别为-2049 kJ/mol、-1887.6 kJ/mol。]
(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性=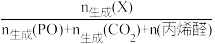 ×100%
×100%
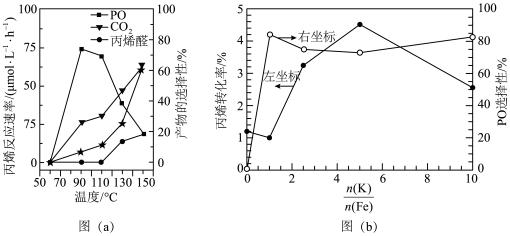
若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是_______ 。
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)
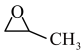 (g)+N2(g)。
(g)+N2(g)。
①已知在325℃时,该催化剂中的钾铁比 对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率
对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率_______ (填“是”或“不是”)对应温度下的平衡转化率,判断理由是_______ 。
②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=_______ kPa(用含a的代数式表示,下同),以上反应用平衡分压代替平衡浓度表示的平衡常数Kp=_______ (列出计算式,分压=总压×物质的量分数)。
(1)“丙烯与氧气直接环氧化法”是最经济和绿色的PO生产途径,有关反应为2CH2=CH-CH3(g)+O2(g)→2
 (g),该反应的△H=
(g),该反应的△H=(2)在以上直接环氧化过程中,丙烯易被氧气部分氧化为丙烯醛,并进而被深度氧化为CO2.图(a)为丙烯反应速率(用★表示)、产物选择性与温度的关系曲线(以c-Cu2O纳米晶为催化剂)。
注:产物(X)选择性=
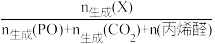 ×100%
×100%
若在实际生产中选择110℃左右作为“丙烯与氧气直接环氧化法”的反应温度,其原因是
(3)在KCl修饰的FeOx/SBA-15催化剂作用下,丙烯也可以被N2O氧化为环氧丙烷,该反应为CH2=CH-CH3(g)+N2O(g)

 (g)+N2(g)。
(g)+N2(g)。①已知在325℃时,该催化剂中的钾铁比
 对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率
对以上反应中丙烯转化率和PO选择性的影响如图(b)所示,当钾铁比=2.5时,丙烯的转化率②350℃下,在一恒容密闭容器进行上述反应,已知起始压强为p(C3H6)=2.5kPa,p(N2O)=25.3kPa.忽略其他副反应,丙烯的平衡转化率为α,则平衡时的p(PO)=
您最近一年使用:0次



