名校
解题方法
1 . (1)已知:①Fe(s)+l/2O2(g)===FeO(s) △H1=—272.0 kJ/mol
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是________________ 。
(2)如图所示的装置中发生反应2A2(g)+B2(g) 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:

①此反应的平衡常数表达式为__________ ;若将温度升高到700℃,反应的平衡常数将____________ (填“增大”、“减小”或“不变”)。
②比较大小:w1________ w2(填“>”、“=”、“<”),a、b、c由大到小的关系___________ 。
③若打开K,一段时间后重新达平衡,容器B的体积将___________ (填“增大”、“减小”或“不变”)。
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系___________ 。
⑤能说明A中已达到平衡状态的是________ (填序号,有一个或多个选项符合题意)。
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是
(2)如图所示的装置中发生反应2A2(g)+B2(g)
 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
①此反应的平衡常数表达式为
②比较大小:w1
③若打开K,一段时间后重新达平衡,容器B的体积将
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系
⑤能说明A中已达到平衡状态的是
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
您最近一年使用:0次
名校
解题方法
2 . 乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g) CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
②2CH3OH(g) C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
③CH3CH2OH(g) CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1
④C2H5OH(g) C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1
回答下列问题:
(1)a=___________ 。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
①欲提高C2H5OH的平衡转化率,应采取的措施为___________ (填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________ ,平衡时C2H5OH的转化率为_______ (结果保留两位有效数字,下同),该反应的平衡常数K=_________ 。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____ mol,n(C2H5OH)=_____ mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______ ,由此规律推出反应在12h时c(C2H5OH)等于______ mol•L-1
①2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1②2CH3OH(g)
 C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1③CH3CH2OH(g)
 CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1④C2H5OH(g)
 C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1回答下列问题:
(1)a=
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(C2H5OH)/(mol•L-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
您最近一年使用:0次
2019-05-06更新
|
87次组卷
|
2卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题
名校
3 . 根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=+244.1 kJ·mol-1 | B.△H=-488.3 kJ·mol-1 |
| C.△H=-996.6 kJ·mol-1 | D.△H=+996.6 kJ·mol-1 |
您最近一年使用:0次
2019-05-06更新
|
276次组卷
|
3卷引用:山西省吕梁市汾阳中学、孝义中学、文水中学2020-2021学年高二上学期期中测评考试化学试题
名校
4 . 25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ/mol
下列说法正确的是
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
| D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
您最近一年使用:0次
2019-01-30更新
|
500次组卷
|
59卷引用:山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题
山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题(已下线)2011-2012学年河北省正定中学高二上学期期中考试化学试卷(已下线)2012届湖北省天门中学高三上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2013届浙江省宁波市金兰合作组织高三上学期期中联考化学试卷2015届北京市第66中学高三上学期期中考试化学试卷2016届湖南省株洲市第二中学高三上学期期中化学试卷2015-2016学年河北省衡水二中高二上期中测试化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2015-2016学年安徽省合肥中科大附中高一下期中化学试卷2016-2017学年浙江省慈溪市高二上学期期中化学试卷浙江省温州中学2016-2017学年高一下学期期中考试化学试题【全国百强校】福建省仙游第一中学2018-2019学年高二上学期期中考试化学试题陕西省榆林市第二中学2018-2019学年高二下学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)山西省运城市景胜中学2020-2021学年高二9月月考化学试题辽宁省辽西联合校2021届高三上学期期中考试化学试题河南省开封市五县2020-2021学年高二上学期期中联考化学试题湖南省雅礼中学2020-2021学年高二上学期期中考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题福建省福州格致中学2023-2024学年高二上学期10月期中考试化学试题(已下线)2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷(已下线)2011-2012学年河南省许昌市五校高一下学期第四次联考化学试卷(已下线)2014届贵州省六盘水市六校上学期期末联合统考理综化学试卷(已下线)2013-2014学年湖北省部分重点中学高二上学期期末考试化学试卷(已下线)2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷2014-2015甘肃省兰州一中高二上学期期末化学试卷2014-2015浙江省严州中学高二1月月考化学试卷2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷2014-2015学年重庆市南开中学高一下学期期末化学试卷2016届黑龙江省哈尔滨三十二中高三上学期期末考试化学试卷2015-2016学年四川省成都市金堂中学高二上学期开学考试化学试卷2015-2016学年甘肃天水一中高一下第一次月考化学试卷2015-2016学年湖北省天门、仙桃、潜江市高一下学期期末化学试卷2016-2017学年湖北省武钢三中高二上月考一化学卷2016-2017学年江西省樟树中学高二上第二次月考化学试卷2016-2017学年江西省樟树中学高二上月考二化学试卷2016-2017学年西藏拉萨北京实验中学高二上期末化学卷湖南省师范大学附属中学2018届高三上学期月考(四)化学试题北京市西城区重点中学2018届高三上学期期末复习检验化学试题【全国百强校】北京市第四中学2017-2018学年高一下学期期末考试化学(选考)试题黑龙江省青冈县一中2018-2019学年高一下学期期末考试(A+班)化学试题辽宁省大连海湾高级中学2019-2020学年高二上学期第一次质量检测化学试题广东省深圳市罗湖区高级中学2019-2020学年高二上学期第一次段考试化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题安徽省庐巢七校联盟2020届高三第五次联考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】2020届高三化学知识点强化训练—盖斯定律(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编陕西省汉中市洋县中学2018-2019学年高二上学期第一次月考化学试题河北省张家口宣化一中2020-2021学年高二上学期12月月考化学试题(已下线)2021年高考化学押题预测卷(湖南卷)(01)(含考试版、答题卡、参考答案、全解全析)青海省海东市第二中学2020-2021学年高二4月月考化学试题(已下线)1.1.2 反应热的测量与计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)北京市第一七一中学2022届高三下学期三模化学试题
名校
5 . 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:________ 。
(2)已知在一定温度下:
①C(s)+CO2(g) 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。
则K1、K2、K3之间的关系是:________ ,△H3=________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________ 。
(1)已知某温度下某反应的化学平衡常数表达式为:K=c(H2O)/[ c(CO)·c(H2)]所对应的化学反应方程式为:
(2)已知在一定温度下:
①C(s)+CO2(g)
 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) △H3 平衡常数K3。
CO(g)+H2(g) △H3 平衡常数K3。则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是
您最近一年使用:0次
6 . I.可逆反应2Cl2(g)+2H2O(g) 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率________ ;v正 ________________ ;
(2)保持容器体积不变,加入He,则HCl的物质的量_______________________ .
(3)保持容器压强不变,加入He,则O2的体积分数______________________ ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度____________ ,相对分子质量 ______________________ .
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):(1)降低温度,Cl2的转化率
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器压强不变,加入He,则O2的体积分数
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
利用CO、H2合成液态甲醇的热化学方程式为
您最近一年使用:0次
名校
7 . (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________ 。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________ kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________ 。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________ 。
反应的热化学方程式为
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
2018-11-30更新
|
137次组卷
|
2卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
8 . 已知下列热化学方程式
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
| A.+131.3 kJ/mol | B.+373.1 kJ/mol |
| C.-131.3 kJ/mol | D.-373.1 kJ/mol |
您最近一年使用:0次
2018-11-29更新
|
132次组卷
|
6卷引用:山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题
山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012-2013学年福建省三明一中高二第一次月考化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷河北省石家庄市元氏县第四中学2020-2021学年高二上学期第一次月考化学试题贵州省安顺市平坝第一高级中学2020-2021学年高二上学期9月月考化学试题
名校
解题方法
9 . 科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
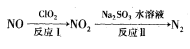
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____ L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____ (填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____ 。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____ ;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____ 。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
(2)利用氧化氮氧化物的流程如下:
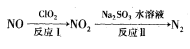
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入
您最近一年使用:0次
9-10高二下·福建泉州·期中
名校
10 . 共价键的断裂有均裂和异裂两种方式,即均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是
| A.2K+2H2O=2KOH+H2↑ |
| B.2Na+2C2H5OH → 2C2H5ONa+H2↑ |
C.Na2CO3+H2O NaHCO3+NaOH NaHCO3+NaOH |
D.CH3COOH+C2H5OH 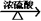 H2O+CH3COOC2H5 H2O+CH3COOC2H5 |
您最近一年使用:0次
2018-06-25更新
|
168次组卷
|
5卷引用:2010—2011学年山西省平遥中学高二下学期期中考试化学试卷
(已下线)2010—2011学年山西省平遥中学高二下学期期中考试化学试卷(已下线)2009—2010泉州七中学年度下学期高二年期中考试化学卷云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题安徽省师范大学附属中学2019届高三上学期9月测试(二)化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题



