1 . 研究化学反应速率和限度对促进生产具有重要的意义。一定条件下铁可以和 发生反应:
发生反应: ,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的
,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和CO气体的浓度与时间的关系如图所示。
气体和CO气体的浓度与时间的关系如图所示。

(1)t1时,浓度商Q与平衡常数K的关系:Q_______ K(填“>”“<”或“=”,下同),
___________  。
。
(2)0-4min内,CO的平均反应速率
___________ 。
(3)下列条件的改变能减慢该反应的反应速率的是___________ (填字母,下同)。
a.降低温度
b.减少铁粉的质量
c.保持压强不变,充入He使容器的体积增大
d.保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是________ 。
a.
b.单位时间内生成nmol 的同时生成nmolCO
的同时生成nmolCO
c.容器中气体压强不随时间而变化
d.容器中气体的平均相对分子质量不随时间而变化
 发生反应:
发生反应: ,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的
,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和CO气体的浓度与时间的关系如图所示。
气体和CO气体的浓度与时间的关系如图所示。
(1)t1时,浓度商Q与平衡常数K的关系:Q

 。
。(2)0-4min内,CO的平均反应速率

(3)下列条件的改变能减慢该反应的反应速率的是
a.降低温度
b.减少铁粉的质量
c.保持压强不变,充入He使容器的体积增大
d.保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是
a.

b.单位时间内生成nmol
 的同时生成nmolCO
的同时生成nmolCOc.容器中气体压强不随时间而变化
d.容器中气体的平均相对分子质量不随时间而变化
您最近一年使用:0次
名校
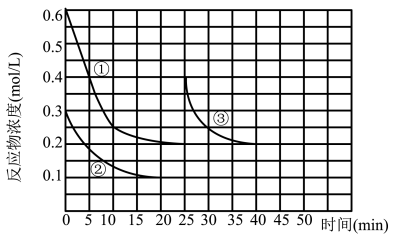
2 . 一定温度下,向1L固定体积的密闭容器中通入 (g)和
(g)和 (g),发生反应
(g),发生反应
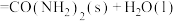 ,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
 (g)和
(g)和 (g),发生反应
(g),发生反应
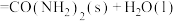 ,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
,测得反应物的浓度随时间变化如图所示。下列说法不正确的是
| A.体系内氨气的体积分数保持不变时达到平衡状态 |
B.前20min内用 表示的平均反应速率为0.01 表示的平均反应速率为0.01 |
| C.该温度下,若定义产物的浓度均为1,反应的化学平衡常数为250 |
D.25min后测得氨气的浓度变化如曲线③,25min时改变的条件是添加0.2mol  和0.1mol 和0.1mol  |
您最近一年使用:0次
名校
解题方法
3 . 下列实验装置(部分夹持装置略)和有关说法均正确的是
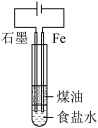 | 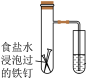 | 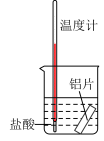 | 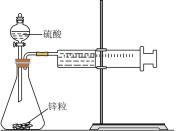 |
| A.铁极逐渐溶解,石墨极附近有白色沉淀生成 | B.右侧导管口有气泡产生 | C.反应剧烈,可用等质量铝粉代替铝片,减缓反应速率 | D.可通过测定一段时间后氢气的体积判断反应快慢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)在25℃、101 kPa下,1 g甲醇完全燃烧生成 和液态
和液态 ,放出22.7 kJ的热量,写出表示甲醇燃烧热的热化学方程式:
,放出22.7 kJ的热量,写出表示甲醇燃烧热的热化学方程式:__________________ 。
(2)若将 设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:
设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:__________________
(3)一定温度下,向2 L恒容密闭容器中充4.0 mol 和6.0 mol NO,在催化剂作用下发生反应:
和6.0 mol NO,在催化剂作用下发生反应:
 ;测得相关数据如下表。
;测得相关数据如下表。
①0~5 min,用NO的浓度变化表示的反应速率为______ 。
②20 min时,保持温度不变,继续向该容器中加入2.0 mol 和3.0 mol NO,反应再次达到平衡时,
和3.0 mol NO,反应再次达到平衡时, 的转化率比原平衡
的转化率比原平衡______ (填“增大”、“减小”或“不变",下同),化学平衡常数比原平衡___________ 。
(4)从某些反应看, 和
和 、
、 和
和 、
、 和
和 、
、 和
和 两两类似。据此判断下列反应正确的是_____(填选项字母)。
两两类似。据此判断下列反应正确的是_____(填选项字母)。
a.
b.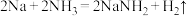
c.
d.
(5)联氨(化学式为 ,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若
,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若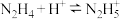 的
的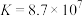 ,
,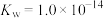 ,联氨第一步电离反应的平衡常数值为
,联氨第一步电离反应的平衡常数值为_____ 。联氨与硫酸形成的正盐的化学式为__________ 。
(1)在25℃、101 kPa下,1 g甲醇完全燃烧生成
 和液态
和液态 ,放出22.7 kJ的热量,写出表示甲醇燃烧热的热化学方程式:
,放出22.7 kJ的热量,写出表示甲醇燃烧热的热化学方程式:(2)若将
 设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:
设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:(3)一定温度下,向2 L恒容密闭容器中充4.0 mol
 和6.0 mol NO,在催化剂作用下发生反应:
和6.0 mol NO,在催化剂作用下发生反应:
 ;测得相关数据如下表。
;测得相关数据如下表。0min | 5min | 10min | 15min | 20min | |
| 4.0 | 2.4 | 1.6 | 1.2 | 1.2 |
| 0 | a | 3.0 | b | b |
①0~5 min,用NO的浓度变化表示的反应速率为
②20 min时,保持温度不变,继续向该容器中加入2.0 mol
 和3.0 mol NO,反应再次达到平衡时,
和3.0 mol NO,反应再次达到平衡时, 的转化率比原平衡
的转化率比原平衡(4)从某些反应看,
 和
和 、
、 和
和 、
、 和
和 、
、 和
和 两两类似。据此判断下列反应正确的是_____(填选项字母)。
两两类似。据此判断下列反应正确的是_____(填选项字母)。a.

b.
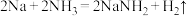
c.

d.

| A.只有a | B.只有c | C.a和b | D.都正确 |
 ,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若
,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若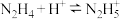 的
的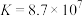 ,
,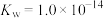 ,联氨第一步电离反应的平衡常数值为
,联氨第一步电离反应的平衡常数值为
您最近一年使用:0次
2023-02-16更新
|
120次组卷
|
2卷引用:安徽省池州市普通高中2022-2023学年高二下学期开学考化学试题
5 .  ,
, 是主要的温室气体,研究发现:将
是主要的温室气体,研究发现:将 与
与 重整可获得合成气(CO,
重整可获得合成气(CO, ),其反应原理为
),其反应原理为 (吸热反应)。请回答下列问题:
(吸热反应)。请回答下列问题:
(1)该反应生成物的总能量_______ (填“大于”或“小于”)反应物的总能量;下列反应属于放热反应的是_______ (填字母序号)。
a.盐酸与碳酸氢钠反应 b.甲烷的燃烧反应
c.灼热的炭与二氧化碳反应 d.氧氧化钡与氯化铵反应
(2)在某一时刻采取下列措施,对该反应的反应速率无影响的是_______ (填字母序号)。
a.恒温恒容下,适当降低反应温度 b.恒温恒容下,再充入适量
c.恒温恒容下,向其中充入惰性气体 d.恒温恒压下,向其中充入惰性气体
(3)在一定条件下,向某2L恒温恒容密闭容器中充入3mol 和4mol
和4mol ,经2min达到平衡状态,此时
,经2min达到平衡状态,此时 。则该时间段内反应的平均反应速率
。则该时间段内反应的平均反应速率
_______ ; 的转化率为
的转化率为_______ 。
(4)以合成气为原料,利用原电池反应可制备甲醇,电池总反应为 ,工作原理如图所示:
,工作原理如图所示:

①已知甲醇的结构式为 ,据此分析碳元素的化合价为
,据此分析碳元素的化合价为_______ 价。
②电子从活性电极_______ (填“M”或“N”)流出沿_______ (填“导线”或“电解质溶液”)流入另一个电极。
③写出M电极生成甲醇的电极反应式:_______ 。
 ,
, 是主要的温室气体,研究发现:将
是主要的温室气体,研究发现:将 与
与 重整可获得合成气(CO,
重整可获得合成气(CO, ),其反应原理为
),其反应原理为 (吸热反应)。请回答下列问题:
(吸热反应)。请回答下列问题:(1)该反应生成物的总能量
a.盐酸与碳酸氢钠反应 b.甲烷的燃烧反应
c.灼热的炭与二氧化碳反应 d.氧氧化钡与氯化铵反应
(2)在某一时刻采取下列措施,对该反应的反应速率无影响的是
a.恒温恒容下,适当降低反应温度 b.恒温恒容下,再充入适量

c.恒温恒容下,向其中充入惰性气体 d.恒温恒压下,向其中充入惰性气体
(3)在一定条件下,向某2L恒温恒容密闭容器中充入3mol
 和4mol
和4mol ,经2min达到平衡状态,此时
,经2min达到平衡状态,此时 。则该时间段内反应的平均反应速率
。则该时间段内反应的平均反应速率
 的转化率为
的转化率为(4)以合成气为原料,利用原电池反应可制备甲醇,电池总反应为
 ,工作原理如图所示:
,工作原理如图所示:
①已知甲醇的结构式为
 ,据此分析碳元素的化合价为
,据此分析碳元素的化合价为②电子从活性电极
③写出M电极生成甲醇的电极反应式:
您最近一年使用:0次
名校
解题方法
6 . 三氯氢硅SiHCl3是制备硅烷、多晶硅的重要原料。对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g)采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
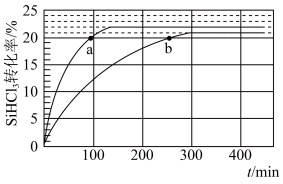
(1)343 K时反应的平衡转化率ɑ=_______ %。平衡常数K343K=_______ (保留2位小数)。
(2)在343 K下,要提高SiHCl3转化率,可采取的措施是_______ ;要缩短反应达到平衡的时间,可采取的措施有_______ 。
(3)比较a、b处反应速率大小:va_______ vb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆=k正x2(SiHCl3)−k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算a处 =
=_______ (保留1位小数)。
 SiH2Cl2(g)+SiCl4(g)采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g)采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
(1)343 K时反应的平衡转化率ɑ=
(2)在343 K下,要提高SiHCl3转化率,可采取的措施是
(3)比较a、b处反应速率大小:va
 =
=
您最近一年使用:0次
2022-05-18更新
|
1612次组卷
|
13卷引用:安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题
安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题山西省临汾市2020届高三上学期第二次月考化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)山东省临沂市兰陵县2021-2022学年高二上学期期中考试化学试题山东省临沂市兰山区、罗庄区2021-2022学年高二上学期中考试化学试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题(已下线)化学反应速率和化学平衡
解题方法
7 . 将6molCO2和8molH2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在10min内CO2的平均反应速率是
CH3OH(g)+H2O(g)。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在10min内CO2的平均反应速率是

 CH3OH(g)+H2O(g)。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在10min内CO2的平均反应速率是
CH3OH(g)+H2O(g)。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在10min内CO2的平均反应速率是
| A.0.5mol·L-1·min-1 |
| B.0.1mol·L-1·min-1 |
| C.0mol·L-1·min-1 |
| D.0.125mol·L-1·min-1 |
您最近一年使用:0次
2022-05-18更新
|
134次组卷
|
14卷引用:安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题
安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题2016届江西师范大学附属中学高三上学期期末化学试卷2017届河北省八所重点中学高三下学期第一次联考化学试卷(已下线)2019年9月19日 《每日一题》2020年高考一轮复习-化学反应速率的计算与比较夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率及其影响因素专练(已下线)考点08 化学反应速率和化学平衡-2020年【衔接教材·暑假作业】新高三一轮复习化学山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)2.1 化学反应速率(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)2.1+化学反应速率-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题河北省衡水市第十四中学2020-2021学年高一下学期一调考试化学试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)
名校
8 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验A、B,可探究出_______ (填外部因素)的改变对化学反应速率的影响,其中
_______ 、
_______ ,通过实验_______ (填实验序号)可探究出温度变化对化学反应速率的影响,其中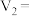
_______ 。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ 。忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
_______ 。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中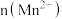 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是_______ 。设计实验证明,分别取等体积等浓度的 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:_______ 。

 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:| 实验序号 | 实验温度/K | 溶液颜色褪至无色所需时间/s | |||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
 |  | 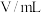 | 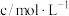 | 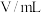 | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| B |  | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 1 |  |


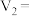
(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(3)该小组的一位同学通过查阅资料发现,上述实验过程中
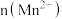 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:
您最近一年使用:0次
2022-04-16更新
|
599次组卷
|
5卷引用:安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题
安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)黑龙江省鹤岗市第一中学2022-2023学年高三上学期10月月考化学试题(已下线)化学反应速率与化学平衡——课时2化学反应速率的影响因素
名校
解题方法
9 . 已知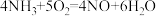 ,反应速率分别用
,反应速率分别用 、
、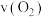 、v(NO)、
、v(NO)、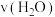 表示,正确的是
表示,正确的是
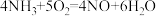 ,反应速率分别用
,反应速率分别用 、
、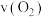 、v(NO)、
、v(NO)、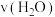 表示,正确的是
表示,正确的是A. | B.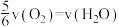 |
C.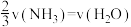 | D.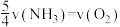 |
您最近一年使用:0次
2021-10-17更新
|
148次组卷
|
7卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题
名校
解题方法
10 . 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。下列说法不正确的是


| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.图甲所示实验中,若左边试管里的反应速率大于右边的,则证明Fe3+对H2O2分解的催化效果比Cu2+的好 |
| C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.为检查乙装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近一年使用:0次
2021-10-10更新
|
281次组卷
|
7卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题

 /mol
/mol /mol
/mol

