名校
1 . 某可逆反应在体积为5L的密闭容器中进行,0~3min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。

(1)该反应的化学方程式为___________ 。
(2)一定温度下,氧化铁可与一氧化碳发生反应: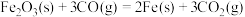 。在2L盛有
。在2L盛有 粉末的密闭容器中通入
粉末的密闭容器中通入 气体,10min后,生成单质铁11.2g。10min内
气体,10min后,生成单质铁11.2g。10min内 =
=_____ 。
(3)在 中,恒容时,下列情况能说明该反应已达到平衡状态的是
中,恒容时,下列情况能说明该反应已达到平衡状态的是___________ (填字母)。
a、
b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、Z的物质的量分数不变
(4)工业上利用 和
和 合成甲醇,催化度应为
合成甲醇,催化度应为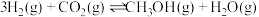 ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如下图。
浓度随时间变化如下图。

①从0min到3min, =
=___________  。
。
②反应前的压强与平衡时的压强之比为___________ 。
③下列表述正确的是___________ (填字母)。
A.第3分钟时 小于第10分钟时
小于第10分钟时
B.混合气体的平均相对分子质量不随时间的变化而变化,反应达到平衡状态
C.达到平衡时 的转化率为75%
的转化率为75%
D.平衡混合气体中 和
和 的质量之比是22:1
的质量之比是22:1

(1)该反应的化学方程式为
(2)一定温度下,氧化铁可与一氧化碳发生反应:
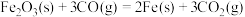 。在2L盛有
。在2L盛有 粉末的密闭容器中通入
粉末的密闭容器中通入 气体,10min后,生成单质铁11.2g。10min内
气体,10min后,生成单质铁11.2g。10min内 =
=(3)在
 中,恒容时,下列情况能说明该反应已达到平衡状态的是
中,恒容时,下列情况能说明该反应已达到平衡状态的是a、

b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、Z的物质的量分数不变
(4)工业上利用
 和
和 合成甲醇,催化度应为
合成甲醇,催化度应为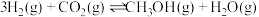 ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入 和
和 进行上述反应,测得
进行上述反应,测得 和
和 浓度随时间变化如下图。
浓度随时间变化如下图。
①从0min到3min,
 =
= 。
。②反应前的压强与平衡时的压强之比为
③下列表述正确的是
A.第3分钟时
 小于第10分钟时
小于第10分钟时
B.混合气体的平均相对分子质量不随时间的变化而变化,反应达到平衡状态
C.达到平衡时
 的转化率为75%
的转化率为75%D.平衡混合气体中
 和
和 的质量之比是22:1
的质量之比是22:1
您最近一年使用:0次
名校
2 . 一定条件下, 能将
能将 转化为
转化为 ,原理为
,原理为 。已知
。已知 ,其中,
,其中, 表示反应速率常数,只与温度有关,m、n、x、y为反应级数,由实验测定。向恒容密闭容器中充入
表示反应速率常数,只与温度有关,m、n、x、y为反应级数,由实验测定。向恒容密闭容器中充入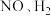 ,在
,在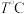 下进行实验,测得有关数据如下:
下进行实验,测得有关数据如下:
下列说法错误的是
 能将
能将 转化为
转化为 ,原理为
,原理为 。已知
。已知 ,其中,
,其中, 表示反应速率常数,只与温度有关,m、n、x、y为反应级数,由实验测定。向恒容密闭容器中充入
表示反应速率常数,只与温度有关,m、n、x、y为反应级数,由实验测定。向恒容密闭容器中充入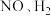 ,在
,在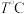 下进行实验,测得有关数据如下:
下进行实验,测得有关数据如下:| 实验 |  | 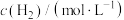 |  |
| ① | 0.10 | 0.10 | 0.414 |
| ② | 0.10 | 0.40 | 1.656 |
| ③ | 0.20 | 0.10 | 1.656 |
| A.上述反应在低温条件下能自发反应 |
B.上述反应中,反应级数: |
C.若升高温度,则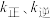 均增大 均增大 |
D.根据题中数据可计算出反应在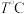 的 的 (平衡常数) (平衡常数) |
您最近一年使用:0次
2024-02-23更新
|
84次组卷
|
3卷引用:2024届安徽省阜阳市皖江名校联盟高三下学期模拟预测化学试题
2024届安徽省阜阳市皖江名校联盟高三下学期模拟预测化学试题江西省部分学校2023-2024学年高三上学期2月月考化学试题(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
3 . 对于可逆反应A(g)+3B(s)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.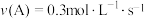 | B. |
C. | D.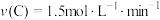 |
您最近一年使用:0次
2024-02-16更新
|
209次组卷
|
3卷引用:安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
名校
4 . 某校课外活动小组利用草酸( )溶液和酸性
)溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,该反应的离子方程式为
溶液之间的反应来探究外界条件改变对化学反应速率的影响,该反应的离子方程式为 ,实验记录如表。
,实验记录如表。
回答下列问题:
(1)通过实验①、②可探究草酸浓度的改变对反应速率的影响,则
_______ ;通过实验_______ 可探究温度变化对化学反应速率的影响。由实验②③可推断
_______ (填“>”“<”或“=”)10s。
(2)若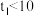 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ ;利用实验②中数据,用 的浓度变化表示的反应平均速率为
的浓度变化表示的反应平均速率为_______  (保留2位有效数字)。
(保留2位有效数字)。
(3)某同学取1支试管加入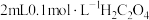 溶液,另取1支试管加入
溶液,另取1支试管加入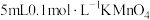 酸性溶液,将两支试管中溶液混合,该同学始终没有看到溶液完全褪色,其原因是
酸性溶液,将两支试管中溶液混合,该同学始终没有看到溶液完全褪色,其原因是_______ 。
(4)已知一定条件下40℃时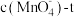 的变化曲线如图。若保持其他条件不变,请在图中用虚线画出20℃时
的变化曲线如图。若保持其他条件不变,请在图中用虚线画出20℃时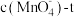 的变化曲线示意图
的变化曲线示意图_______ 。

 )溶液和酸性
)溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,该反应的离子方程式为
溶液之间的反应来探究外界条件改变对化学反应速率的影响,该反应的离子方程式为 ,实验记录如表。
,实验记录如表。| 实验序号 | 实验温度/℃ |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
| V/mL | 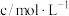 | V/mL | 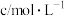 | V/mL | |||
| ① | 20 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| ② | 20 | 2 | 0.02 | 4 | 0.1 |  | 10 |
| ③ | 40 | 2 | 0.02 | 4 | 0.1 | 6 |  |
(1)通过实验①、②可探究草酸浓度的改变对反应速率的影响,则


(2)若
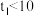 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应平均速率为
的浓度变化表示的反应平均速率为 (保留2位有效数字)。
(保留2位有效数字)。(3)某同学取1支试管加入
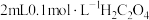 溶液,另取1支试管加入
溶液,另取1支试管加入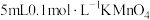 酸性溶液,将两支试管中溶液混合,该同学始终没有看到溶液完全褪色,其原因是
酸性溶液,将两支试管中溶液混合,该同学始终没有看到溶液完全褪色,其原因是(4)已知一定条件下40℃时
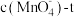 的变化曲线如图。若保持其他条件不变,请在图中用虚线画出20℃时
的变化曲线如图。若保持其他条件不变,请在图中用虚线画出20℃时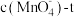 的变化曲线示意图
的变化曲线示意图
您最近一年使用:0次
2023-09-08更新
|
168次组卷
|
5卷引用:安徽省阜阳市城郊中学2023-2024学年高二上学期第一次月考化学试题
解题方法
5 . 反应条件的选择是工业生产的重点课题,既要有适当的反应速率,又要有适当的转化效率(即反应限度)。
(1)某实验小组在实验室模拟工业合成氨。在5L恒温恒容密闭容器中充入1.95molH2和0.65molN2,反应一段时间后容器中NH3的浓度变化如图所示。
①已知N2的沸点为-195℃、O2的沸点为-183℃,则从液态空气中分离获得原料N2时,从液态空气中先汽化的是______ (填“N2”或“O2”)。
②0~12min内,用H2表示的化学反应速率v(H2)=______ 。
③该温度下,达到平衡状态时, =
=______ L2•mol-2(结果保留三位有效数字)。
(2)该实验小组为探究外界条件对化学反应速率的影响进行如下实验。
i.探究常温下等质量金属与酸反应生成氢气速率的影响因素,进行如表实验:
①实验Ⅰ中没发现生成氢气是因为______ 。由实验Ⅱ、Ⅲ可以得到的结论是______ 。由实验Ⅱ、Ⅳ可以得到的结论是______ 。
②甲同学在进行实验Ⅳ时又加入了少量硫酸铜固体,意外发现生成气体速率明显加快,试分析其原因:______ 。
ii.已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表所示(所取溶液体积均为2mL)。
③由表中数据可知,反应速率由大到小的顺序为______ (用编号表示)。
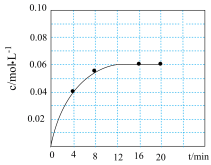
(1)某实验小组在实验室模拟工业合成氨。在5L恒温恒容密闭容器中充入1.95molH2和0.65molN2,反应一段时间后容器中NH3的浓度变化如图所示。

①已知N2的沸点为-195℃、O2的沸点为-183℃,则从液态空气中分离获得原料N2时,从液态空气中先汽化的是
②0~12min内,用H2表示的化学反应速率v(H2)=
③该温度下,达到平衡状态时,
 =
=(2)该实验小组为探究外界条件对化学反应速率的影响进行如下实验。
i.探究常温下等质量金属与酸反应生成氢气速率的影响因素,进行如表实验:
| 实验编号 | 金属 | c(酸)/(mol•L-1) | 溶液体积/mL |
| Ⅰ | 铁块 | 18.4mol•L-1硫酸 | 10 |
| Ⅱ | 铁粉 | 2mol•L-1硫酸 | 10 |
| Ⅲ | 铁粉 | 2mol•L-1盐酸 | 20 |
| Ⅳ | 铁块 | 2mol•L-1硫酸 | 10 |
①实验Ⅰ中没发现生成氢气是因为
②甲同学在进行实验Ⅳ时又加入了少量硫酸铜固体,意外发现生成气体速率明显加快,试分析其原因:
ii.已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表所示(所取溶液体积均为2mL)。
| 实验编号 | 温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| a | 25 | 0.1 | 0.1 |
| b | 25 | 0.2 | 0.1 |
| c | 50 | 0.2 | 0.1 |
③由表中数据可知,反应速率由大到小的顺序为
您最近一年使用:0次
名校
6 . 用 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为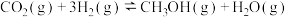 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1mol
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1mol 和3mol
和3mol 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中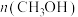 随时间的变化情况如下表:
随时间的变化情况如下表:
下列说法正确的是
 和
和 合成甲醇有利于减少碳排放,其反应原理为
合成甲醇有利于减少碳排放,其反应原理为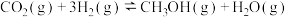 。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1mol
。向甲、乙两个体积都为2.0L的恒容密闭容器中均充入1mol 和3mol
和3mol 的混合气体,分别在
的混合气体,分别在 、
、 温度下进行反应并达到平衡,反应过程中甲、乙两容器中
温度下进行反应并达到平衡,反应过程中甲、乙两容器中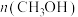 随时间的变化情况如下表:
随时间的变化情况如下表:| t/min | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器( )/mol )/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器( )/mol )/mol | 0 | 0.34 | 0.55 | 0.70 | 0.83 | 0.83 |
A.两容器的温度: |
B.甲容器中,0~6min内用 表示的平均反应速率为0.3 表示的平均反应速率为0.3 |
| C.甲容器中反应达平衡时容器内气体压强与起始时容器内气体压强之比为2:5 |
D.甲容器中反应达平衡时 的转化率为80% 的转化率为80% |
您最近一年使用:0次
2023-05-22更新
|
591次组卷
|
3卷引用: 安徽省阜南实验中学2022-2023学年高一下学期5月月考化学试题
名校
7 . 已知 和
和 可以相互转化
可以相互转化 ,反应每生成1mol
,反应每生成1mol 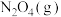 ,放出24.2kJ的热量。在恒温条件下,将一定量的
,放出24.2kJ的热量。在恒温条件下,将一定量的 和
和 混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是

 和
和 可以相互转化
可以相互转化 ,反应每生成1mol
,反应每生成1mol 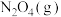 ,放出24.2kJ的热量。在恒温条件下,将一定量的
,放出24.2kJ的热量。在恒温条件下,将一定量的 和
和 混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法错误的是
A.曲线X表示 浓度的变化 浓度的变化 |
B.前10min内用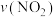 表示的化学反应速率为0.02mol/(L·min) 表示的化学反应速率为0.02mol/(L·min) |
C.图中a、b、c、d四个点中,a、c两点的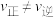 |
| D.反应进行到10min时放出的热量为9.68kJ |
您最近一年使用:0次
2023-04-30更新
|
342次组卷
|
3卷引用:安徽省阜阳市临泉第一中学(高铁分校)2022-2023学年高一下学期第三次月考化学试题
解题方法
8 . 下列图像及对应的叙述错误的是
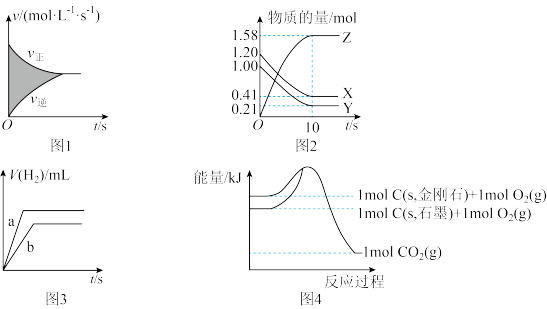
| A.图1中的阴影部分代表反应物浓度实际减小的量 |
B.图2中所示反应的化学方程式可以表示为X+Y 2Z 2Z |
| C.图3表示足量锌分别与500mL0.1mol•L-1盐酸、200mL0.1mol•L-1硫酸反应产生氢气的体积随时间变化的图像 |
| D.图4表示等质量的金刚石、石墨在氧气中完全燃烧时放出的热量不相等 |
您最近一年使用:0次
2023-04-29更新
|
664次组卷
|
3卷引用:安徽省阜南县2022-2023学年高一下学期4月期中考试化学试题
安徽省阜南县2022-2023学年高一下学期4月期中考试化学试题江西省新余市2022-2023学年高一下学期期末质量检测化学试题(已下线)提升练04 化学平衡图像分析-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
9 .  为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。
为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。
(1)已知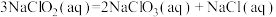
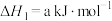
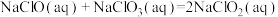
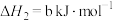
则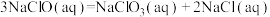

___________  (用含a、b式子表示)。
(用含a、b式子表示)。
(2)浓度均为0.1
 和
和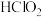 混合溶液呈酸性,则溶液中微粒浓度大小关系:
混合溶液呈酸性,则溶液中微粒浓度大小关系: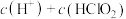
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)工业上可用电解法制备 ,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得
,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得 粗品。
粗品。

M处是外接直流电源的___________ 极(填“正”或“负”);离子交换膜应选择___________ (填“阴”或“阳”)离子交换膜;当外电路转移0.1mol电子时,理论上Pt(B)电极区电解质溶液质量减少___________ g。
(4)以 为氧化剂是一种新型脱除NO方法,其原理为:
为氧化剂是一种新型脱除NO方法,其原理为:
第一步:NO在碱性环境中被氧化为 ,反应为:
,反应为: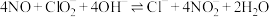 ;
;
第二步: 继续被氧化为
继续被氧化为 ,反应为:
,反应为: 。
。
① 溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是
溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是___________ (填“提高”“无影响”或“降低”)。
②在50℃时,将NO匀速通过足量浓度为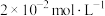
 碱性溶液,3min后,测得溶液中
碱性溶液,3min后,测得溶液中 浓度为
浓度为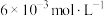 。则该时间段内平均反应速率
。则该时间段内平均反应速率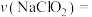
___________ (反应前后溶液的体积变化忽略不计)。
 为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。
为高效漂白剂和氧化剂,可用于纸浆、纸张和各种纤维的漂白,也在环境治理中有所应用。(1)已知
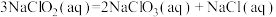
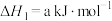
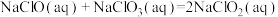
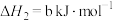
则
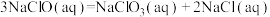

 (用含a、b式子表示)。
(用含a、b式子表示)。(2)浓度均为0.1

 和
和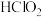 混合溶液呈酸性,则溶液中微粒浓度大小关系:
混合溶液呈酸性,则溶液中微粒浓度大小关系: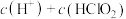
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)工业上可用电解法制备
 ,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得
,其工作原理如图所示(NaCl足量),电解一段时间后,将Pt(A)电极区的溶液除去微量二氧化氯后,喷雾干燥即得 粗品。
粗品。
M处是外接直流电源的
(4)以
 为氧化剂是一种新型脱除NO方法,其原理为:
为氧化剂是一种新型脱除NO方法,其原理为:第一步:NO在碱性环境中被氧化为
 ,反应为:
,反应为: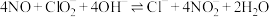 ;
;第二步:
 继续被氧化为
继续被氧化为 ,反应为:
,反应为: 。
。①
 溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是
溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是②在50℃时,将NO匀速通过足量浓度为
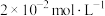
 碱性溶液,3min后,测得溶液中
碱性溶液,3min后,测得溶液中 浓度为
浓度为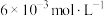 。则该时间段内平均反应速率
。则该时间段内平均反应速率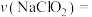
您最近一年使用:0次
名校
10 . 2023年3月燃油汽车为了促销,价格暴跌甚至降低到了匪夷所思的地步,其重要原因之一是:汽车尾气有污染,汽车尾气中含有 、
、 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:

该条件下, 和
和 完全反应生成
完全反应生成 ,会
,会_______ (填“吸收”或“放出”) _______  能量。
能量。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 ,化学方程式为:
,化学方程式为: 。
。
①某温度下,在容积不变的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为_______  。
。
②下列可以标明上述反应已达到平衡状态的是_______ 。
a.容器中的气体压强保持不变 b. 、
、 、
、 、
、 的浓度之比为
的浓度之比为
c. 的浓度不再改变 d.相同时间内,反应消耗
的浓度不再改变 d.相同时间内,反应消耗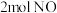 同时消耗
同时消耗
(3)在反应物初始浓度相同,实验温度为200℃和300℃条件下,进行以下实验:
【实验分析与结论】
①补全表格:a._______ ;b. _______ 。
②测得 ,对比实验1、3,可得结论:
,对比实验1、3,可得结论:_______ 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验1、2,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
 、
、 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:
该条件下,
 和
和 完全反应生成
完全反应生成 ,会
,会 能量。
能量。(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 ,化学方程式为:
,化学方程式为: 。
。①某温度下,在容积不变的密闭容器中通入
 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | … |
 | 4.00 | 3.45 | 3.10 | 2.95 | … |
 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为 。
。②下列可以标明上述反应已达到平衡状态的是
a.容器中的气体压强保持不变 b.
 、
、 、
、 、
、 的浓度之比为
的浓度之比为
c.
 的浓度不再改变 d.相同时间内,反应消耗
的浓度不再改变 d.相同时间内,反应消耗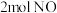 同时消耗
同时消耗
(3)在反应物初始浓度相同,实验温度为200℃和300℃条件下,进行以下实验:
| 实验编号 | 实验目的 | 温度 (℃) | 同种催化剂的比表面积(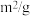 ) ) | 达平衡时所用时间(s) |
| 1 | 对照试验 | 200 | 50 |  |
| 2 | 研究催化剂的比表面积 对尾气转化速率的影响 | 200 | 80 |  |
| 3 | a | 300 | b |  |
①补全表格:a.
②测得
 ,对比实验1、3,可得结论:
,对比实验1、3,可得结论:③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验1、2,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
2023-04-13更新
|
533次组卷
|
5卷引用: 安徽省阜南实验中学2022-2023学年高一下学期5月月考化学试题



