1 . 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ·mol-1、283.0kJ·mol-1、285.8kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=__ 。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
①用H2表示前2h平均反应速率v(H2)=___ 。
②该温度下CO2的平衡转化率为___ 。
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ·mol-1、283.0kJ·mol-1、285.8kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2h平均反应速率v(H2)=
②该温度下CO2的平衡转化率为
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=
您最近一年使用:0次
名校
2 . 已知N2O4(g) 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)20s时,N2O4的分解率是___ 。
(2)40s时,NO2的浓度为___ ,0~40s内N2O4的平均反应速率为____ 。
(3)在80℃时该反应的平衡常数K值为___ 。
(4)判断t2、t3、t4时刻对该反应采取的措施。
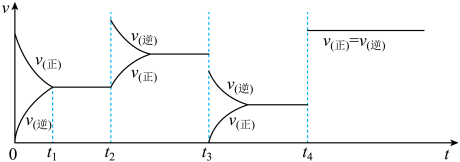
t2:___ ;t3:___ ;t4:___ 。
 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.12 | c | d | e |
| c(NO2) | 0.00 | 0.08 | b | 0.20 | 0.20 | 0.20 |
(1)20s时,N2O4的分解率是
(2)40s时,NO2的浓度为
(3)在80℃时该反应的平衡常数K值为
(4)判断t2、t3、t4时刻对该反应采取的措施。

t2:
您最近一年使用:0次
解题方法
3 . 250℃和100kPa下密闭容器中发生反应:PCl5(g) PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
(1)PCl5的分压是___ kPa。(保留三位有效数字)
(2)250℃时用分压表达的平衡常数Kp=___ kPa。(保留三位有效数字)
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是___ ,理由是___ 。
 PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。(1)PCl5的分压是
(2)250℃时用分压表达的平衡常数Kp=
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是
您最近一年使用:0次
4 . 一定温度下,将4mol N2,10mol H2通入10L的定容密闭容器中进行反应:
N2 (g)+ 3H2(g) 2NH3(g),10 min反应达到平衡,此时测得
2NH3(g),10 min反应达到平衡,此时测得 N2 浓度为0.2 mol/L。
N2 浓度为0.2 mol/L。
(1)10 min内,用H2浓度变化来表示的反应速率为___________ ,平衡时NH3的物质的量为___________ ;
(2)平衡时N2和H2的转化率之比为___________ ;该温度下平衡常数K的值为___________ ;
(3)若起始将2mol N2,5mol H2通入10L的定容密闭容器中进行反应,在相同温度下再达到平衡时NH3的物质的量是___________ ;
A.4 mol B.2mol C.小于2 mol D.大于2 mol,小于4 mol
N2 (g)+ 3H2(g)
 2NH3(g),10 min反应达到平衡,此时测得
2NH3(g),10 min反应达到平衡,此时测得 N2 浓度为0.2 mol/L。
N2 浓度为0.2 mol/L。(1)10 min内,用H2浓度变化来表示的反应速率为
(2)平衡时N2和H2的转化率之比为
(3)若起始将2mol N2,5mol H2通入10L的定容密闭容器中进行反应,在相同温度下再达到平衡时NH3的物质的量是
A.4 mol B.2mol C.小于2 mol D.大于2 mol,小于4 mol
您最近一年使用:0次
2020-12-22更新
|
86次组卷
|
2卷引用:甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题
名校
解题方法
5 . 恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1,计算:
xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1,计算:
(1)x的数值___
(2)此反应在该温度时的化学平衡常数为是多少___ ?
(3)反应前容器内的压强与平衡后容器内的压强之比__ ?
(4)保持温度和容积不变,向平衡体系中再充入2mol A和2mol B气体,达到新平衡时B的物质的量为__ 。
 xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1,计算:
xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2mol B,并测得C的浓度为1.2mol·L-1,计算:(1)x的数值
(2)此反应在该温度时的化学平衡常数为是多少
(3)反应前容器内的压强与平衡后容器内的压强之比
(4)保持温度和容积不变,向平衡体系中再充入2mol A和2mol B气体,达到新平衡时B的物质的量为
您最近一年使用:0次
解题方法
6 . 在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。
列式计算:
(1)NO2的转化率为多少?_______
(2)该温度下反应的平衡常数。_______
(3)在这5分钟内,用O2来表示的平均反应速率是多少?_______
 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。列式计算:
(1)NO2的转化率为多少?
(2)该温度下反应的平衡常数。
(3)在这5分钟内,用O2来表示的平均反应速率是多少?
您最近一年使用:0次
解题方法
7 . 2.0molCO和2.0molH2O充入体积为2L的密闭容器中,在一定条件下发生反应CO(g)+H2O(g) CO2(g)+H2(g),达平衡时CO2为1mol,
CO2(g)+H2(g),达平衡时CO2为1mol,
(1)该条件下该反应的平衡常数是_______ 。
(2)如果此时再加入1molCO,则再次平衡时H2的浓度为______ 。
 CO2(g)+H2(g),达平衡时CO2为1mol,
CO2(g)+H2(g),达平衡时CO2为1mol,(1)该条件下该反应的平衡常数是
(2)如果此时再加入1molCO,则再次平衡时H2的浓度为
您最近一年使用:0次
8 . 利用I2O5可消除CO污染,其反应为:I2O5(s)+5CO(g) 5CO2(g)+I2(s)。在不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s)。在不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
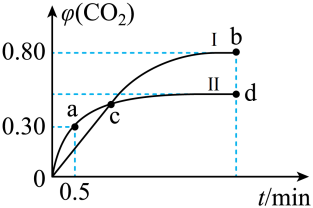
(1)曲线Ⅱ0~0.5min内的平均反应速率v(CO)═___________ 。
(2)b点时,CO的转化率为___________ 。
(3)b点和d点的化学平衡常数:Kb___________ Kd(填“>”、“<”或“═”)。
 5CO2(g)+I2(s)。在不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s)。在不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
(1)曲线Ⅱ0~0.5min内的平均反应速率v(CO)═
(2)b点时,CO的转化率为
(3)b点和d点的化学平衡常数:Kb
您最近一年使用:0次
解题方法
9 . 工业合成氨反应为:N2(g)+3H2(g) 2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
计算:
(1)前10分钟内平均反应速率v(N2)=______ 。
(2)该温度下此反应的平衡常数K=_____ 。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,通过计算判断此时v正和v逆相对大小____ 。
 2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
计算:
(1)前10分钟内平均反应速率v(N2)=
(2)该温度下此反应的平衡常数K=
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,通过计算判断此时v正和v逆相对大小
您最近一年使用:0次
10 . 化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3个热化学方程式(K为平衡常数):
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H1=-1266.8kJ•mol-1 K1
2N2(g)+6H2O(g)△H1=-1266.8kJ•mol-1 K1
②N2(g)+O2(g) 2NO(g)△H2=180.5kJ•mol-1 K2
2NO(g)△H2=180.5kJ•mol-1 K2
③4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3 K3
则△H3=___________ ,K3=___________ (用K1、K2表示)。
①4NH3(g)+3O2(g)
 2N2(g)+6H2O(g)△H1=-1266.8kJ•mol-1 K1
2N2(g)+6H2O(g)△H1=-1266.8kJ•mol-1 K1②N2(g)+O2(g)
 2NO(g)△H2=180.5kJ•mol-1 K2
2NO(g)△H2=180.5kJ•mol-1 K2③4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3 K3
则△H3=
您最近一年使用:0次



