1 . 用沉淀溶解平衡原理解释不正确的是
A.误食钡盐[ 或 或 ]后,常用 ]后,常用 的 的 溶液解毒 溶液解毒 |
| B.升高温度,沉淀溶解平衡一定正向移动 |
C.向饱和 溶液中通入 溶液中通入 ,会看到有白色晶体析出 ,会看到有白色晶体析出 |
D.向浓度均为 的 的 和 和 混合溶液中滴加少量 混合溶液中滴加少量 溶液,出现淡黄色沉淀,说明 溶液,出现淡黄色沉淀,说明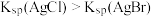 |
您最近一年使用:0次
2 . 常温下,向 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是
 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是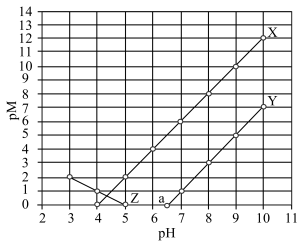
A.X、Z分别代表 与 与 的关系 的关系 |
B.常温下,弱酸 的电离常数 的电离常数 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中 |
D.向浓度均为 的 的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入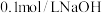 溶液,能通过沉淀的方式将两种离子分离 溶液,能通过沉淀的方式将两种离子分离 |
您最近一年使用:0次
名校
解题方法
3 . 氧化钴(Co2O3)常用作超耐热合金和磁性材料及化学工业的催化剂。一种以钴矿渣(含有Co、Fe、Ca、Mg、Mn、Ni等元素的化合物及 )制备
)制备 的工艺流程如下。
的工艺流程如下。

已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
② 、
、 可溶于水。
可溶于水。
回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有___________ (任写两点);滤渣1的主要成分为___________ (填化学式)。
(2)“除铁”过程中, 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
(3)“萃取”“反萃取”步骤的目的是___________ ;“煅烧”时主要反应的化学方程式为___________ 。
(4)以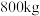 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为___________ (计算结果保留三位有效数字)。
 )制备
)制备 的工艺流程如下。
的工艺流程如下。
已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
②
 、
、 可溶于水。
可溶于水。回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有
(2)“除铁”过程中,
 参与反应的离子方程式为
参与反应的离子方程式为(3)“萃取”“反萃取”步骤的目的是
(4)以
 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为
您最近一年使用:0次
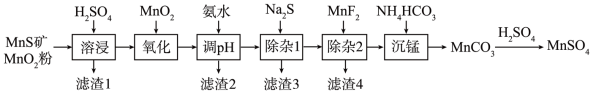
4 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
(1)“滤渣1”含有S和_______ ; 写出“溶浸”中二氧化锰与硫化锰反应的化学方程式为_______
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为_______ 。
(3)调pH范围为4.7~6,滤渣2成分的化学式为_________ 。
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是__________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______ 。
(6)写出“沉锰”的离子方程式_______
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1mol∙L-1]形成氢氧化物沉淀的 pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe³⁺ | Al3⁺ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将 Fe2+氧化为 Fe3+,写出该反应的离子方程式为
(3)调pH范围为4.7~6,滤渣2成分的化学式为
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4 当x=y=
 时,z=
时,z=
您最近一年使用:0次
名校
5 . 下列有关实验的现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向浓度均为0.10 mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向某浓度的K2CrO4溶液中缓慢滴加少许浓氢氧化钠溶液 | 溶液颜色由黄色变为橙红色 | 减小氢离子浓度,该溶液中的平衡向生成 的方向移动 的方向移动 |
| C | 向盛有某溶液的试管中滴加少量稀NaOH溶液 | 未产生使湿润的红色石蕊试纸变蓝的气体 | 该溶液中不含铵根 |
| D | 用pH计测定pH:①Na2CO3溶液②NaClO溶液 | pH:①>② | H2CO3酸性弱于HClO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-17更新
|
474次组卷
|
4卷引用:四川省遂宁市2023-2024学年高三上学期11月期中理综化学试题
6 . 常温下,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是


| A.向X点对应溶液中加入适量的NaOH溶液,有可能得到Z点对应溶液 |
| B.相同温度下,Ksp(CdCO3)=100Ksp(Cd(OH)2) |
| C.Y点对应的CdCO3分散系中,v(溶解)>v(沉淀) |
| D.常温下,CdCO3、Cd(OH)2饱和溶液,前者c(Cd2+)较大 |
您最近一年使用:0次
2023-11-06更新
|
1174次组卷
|
8卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期12月月考化学试题
四川省宜宾市第四中学校2023-2024学年高二上学期12月月考化学试题(已下线)T13-水溶液中的离子平衡河南省湘豫名校联考2023-2024学年高三上学期11月期中考试化学试题(已下线)选择题11-16辽宁省沈阳市东北育才学校高中部2023-2024学年高二上学期第二次月考化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题山东省青岛第二中学2023-2024学年高二上学期12月份月考化学试卷
名校
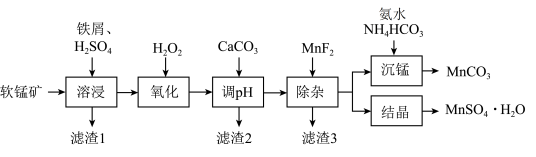
7 . 由软锰矿(主要成分是MnO2,还含有Al2O3、MgO、SiO2等杂质)制备高纯碳酸锰、硫酸锰的一种工艺流程如图所示。
已知:①25℃时,Ksp(MnCO3)=1.8 10-11,Ksp(CaF2)=1.5
10-11,Ksp(CaF2)=1.5 10-10,Ksp(MgF2)=7.4
10-10,Ksp(MgF2)=7.4 10-11。
10-11。
②一定条件下,一些金属氢氧化物沉淀时的pH如表所示。
回答下列问题:
(1)除去铁屑表面油污,可采用的方法是___________ 。
(2)已知“溶浸”时,Fe不能还原MnO2,但Fe2+能还原MnO2得到Mn2+。Fe2+还原MnO2的离子方程式是___________ 。
(3)“氧化”时,过氧化氢的实际消耗量远大于理论消耗量,其原因可能是___________ 。
(4)用CaCO3 “调pH”虽然成本较低,但会引入Ca2+等杂质,若使用___________ (填化学式) “调pH”可避免此问题;调节pH步骤中,应控制的pH范围是___________ 。
(5)滤渣3的主要成分是___________ (填化学式)。
(6)“沉锰”时发生反应的离子方程式为___________ 。
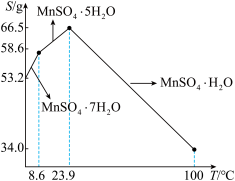
(7)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图所示。“结晶”是从“除杂”后过滤所得的滤液中获得MnSO4·H2O。其操作是___________ ,___________ ,洗涤,真空干燥。

已知:①25℃时,Ksp(MnCO3)=1.8
 10-11,Ksp(CaF2)=1.5
10-11,Ksp(CaF2)=1.5 10-10,Ksp(MgF2)=7.4
10-10,Ksp(MgF2)=7.4 10-11。
10-11。②一定条件下,一些金属氢氧化物沉淀时的pH如表所示。
| 金属氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 6.8 | 2.3 | 8.1 | 3.4 |
| 完全沉淀的pH | 8.3 | 3.2 | 10 | 4.7 |
(1)除去铁屑表面油污,可采用的方法是
(2)已知“溶浸”时,Fe不能还原MnO2,但Fe2+能还原MnO2得到Mn2+。Fe2+还原MnO2的离子方程式是
(3)“氧化”时,过氧化氢的实际消耗量远大于理论消耗量,其原因可能是
(4)用CaCO3 “调pH”虽然成本较低,但会引入Ca2+等杂质,若使用
(5)滤渣3的主要成分是
(6)“沉锰”时发生反应的离子方程式为
(7)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如图所示。“结晶”是从“除杂”后过滤所得的滤液中获得MnSO4·H2O。其操作是

您最近一年使用:0次
2023-11-05更新
|
305次组卷
|
2卷引用:四川省成都市实验外国语学校2023-2024学年高三上学期10月检测理综化学试题
解题方法
8 . 七水合硫酸镁(MgSO4•7H2O)在印染、造纸等领域应用广泛。以化工废弃物盐泥(主要成分为MgCO3•CaCO3,含少量NaCl与含铁化合物)为原料可制取七水合硫酸镁,回答下列问题:
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为________ ;配制3.0mol•L-1H2SO4溶液时,用到的实验仪器除烧杯、玻璃棒、量筒外,还必须使用的仪器有________ (填标号)。
A. B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是________ 、________ ,继续加热煮沸的目的是________ 。
(3)要证明铁元素已除尽,实验操作及现象是:________ 。
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是________ ,将滤渣完全溶于3.0mol•L-1H2SO4溶液,经如下实验操作:加热蒸发、________ 、过滤、洗涤、干燥,得到七水合硫酸镁。
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为________ %,将产品加热至77℃,测得固体失重率为43.9%,该温度下固体的化学式为________ 。
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为
A.
 B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是
(3)要证明铁元素已除尽,实验操作及现象是:
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为
您最近一年使用:0次
9 . 常温下,CaF2、BaF2的沉淀溶解曲线如图所示。下列叙述错误的是
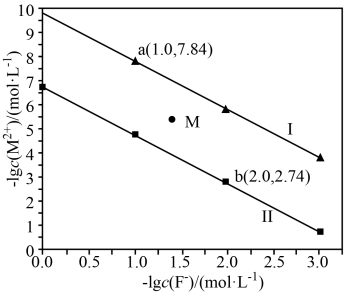
已知:CaF2的溶解度小于BaF2,M代表Ba或Ca

已知:CaF2的溶解度小于BaF2,M代表Ba或Ca
A.曲线Ⅰ代表  与-lgc(F⁻)的关系 与-lgc(F⁻)的关系 |
B.常温下,  |
| C.M点对应的溶液是 BaF2的过饱和溶液 |
D. 的平衡常数 K 为103.1 的平衡常数 K 为103.1 |
您最近一年使用:0次
2023-10-17更新
|
772次组卷
|
6卷引用:溶液中的离子平衡
10 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含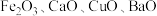 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。 如表。
如表。
回答下列问题:
(1)浸出渣主要成分为___________ 、___________ 。(填化学式)
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”的目的是将溶液中 氧化为
氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。温度需控制在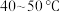 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)“除钙”后,若溶液中 浓度为
浓度为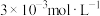 ,则
,则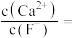
___________ 。[已知常温下, ]
]
(6)用可溶性碳酸盐,可以浸取 固体,在溶液浸取过程发生反应:
固体,在溶液浸取过程发生反应: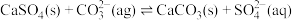 。已知:
。已知: 时,
时,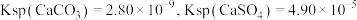 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为___________ (计算结果保留三位有效数字)。
 ,另含
,另含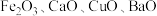 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。
 如表。
如表。| 氢氧化物 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.7 |
沉淀完全的 | 3.7 | 9.7 | 9.2 |
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)“氧化”的目的是将溶液中
 氧化为
氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式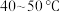 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)“除钙”后,若溶液中
 浓度为
浓度为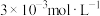 ,则
,则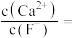
 ]
](6)用可溶性碳酸盐,可以浸取
 固体,在溶液浸取过程发生反应:
固体,在溶液浸取过程发生反应: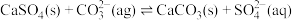 。已知:
。已知: 时,
时,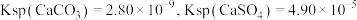 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为
您最近一年使用:0次
2023-09-16更新
|
869次组卷
|
4卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题



