名校
1 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入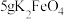 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
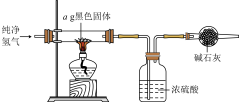
当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
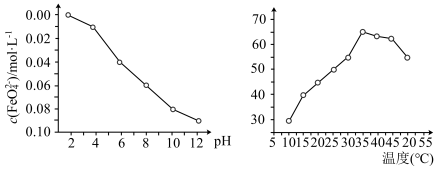
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明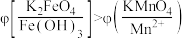 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
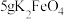 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
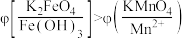 。
。
您最近一年使用:0次
2 . 某小组设计实验探究重铬酸铵[(NH4)2Cr2O7]的部分性质:资料显示:
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。
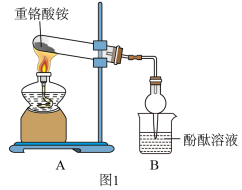
B中倒置的干燥管作用是_____________________ 。实验中,没有观察到B中颜色发生变化,实验结论是_________________________________ 。
(2)探究(NH4)2Cr2O7 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下装置可以重复使用 ):
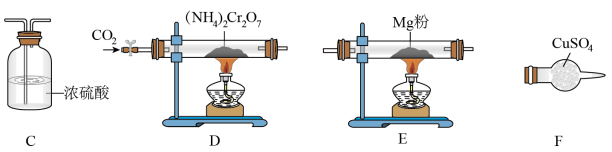
①气流从左至右,装置连接顺序D、________________________________ 。
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是_______________ 能证明有水生成的实验现象是_________________ 。
③能说明D中分解反应已发生的实验依据是_______________ 。
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,____ 。
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。
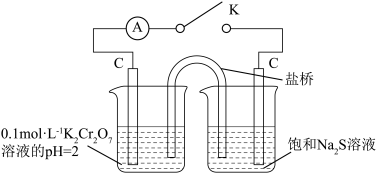
图2中负极的电极反应式为________________________ (不考虑后续反应)。
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。

B中倒置的干燥管作用是
(2)探究(NH4)2Cr2O7
 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下
①气流从左至右,装置连接顺序D、
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是
③能说明D中分解反应已发生的实验依据是
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。

图2中负极的电极反应式为
您最近一年使用:0次
3 . 某小组研究Na2S 溶液与KMnO4溶液反应,探究过程如下。
资料:i. 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有_______ 性。
(2)甲同学预测实验I中S2-被氧化成 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______ 。
②乙同学取实验I中少量溶液进行实验,检测到有 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是_______ 。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
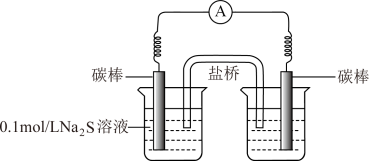
a.右侧烧杯中的溶液是_______ 。
b.连通后电流计指针偏转,一段时间后,_______ (填操作和现象)。
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是_______ 。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是_______ 。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与_______ 因素有关。
| 实验序号 | I | II |
| 实验过程 | 加10滴(约0.3mL) 溶液 溶液 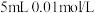 酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) ) | 滴加10滴约(0.3mL)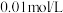 酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) )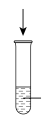  溶液 溶液 |
| 实验现象 | 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) | 溶液呈淡黄色(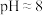 ),生成浅粉色沉淀( ),生成浅粉色沉淀( ) ) |
 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有
(2)甲同学预测实验I中S2-被氧化成
 。
。 ①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验I中少量溶液进行实验,检测到有
 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
a.右侧烧杯中的溶液是
b.连通后电流计指针偏转,一段时间后,
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(
 )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次
4 . 某实验小组研究溶液中 和
和 的反应。
的反应。
(1)该实验小组同学认为黑色沉淀中可能含有 、
、 或Ag,设计实验验证。
或Ag,设计实验验证。
已知:ⅰ.浓硝酸能将 转化为
转化为 和
和 ;
;
ⅱ. 能溶解在浓氨水中形成银氨溶液,而
能溶解在浓氨水中形成银氨溶液,而 和Ag均不能。
和Ag均不能。
①设计并进行如图1所示实验,证实黑色沉淀中含有 。
。

试剂1和试剂2分别是_______ 、_______ 。现象1和现象2分别是_______ 、_______ 。
②设计并进行如下实验,证实黑色沉淀中不含有 ,将实验操作和现象补充完整。
,将实验操作和现象补充完整。
③经检验,黑色沉淀不含有Ag。
(2)该实验小组同学认为 溶液具有氧化性,在一定条件下能够氧化
溶液具有氧化性,在一定条件下能够氧化 ,设计实验进行探究,实验装置如图2所示。测得电压为
,设计实验进行探究,实验装置如图2所示。测得电压为 。对
。对 溶液中氧化
溶液中氧化 的物质进行推测。
的物质进行推测。
假设1:0.1 mol/L 溶液中的
溶液中的 氧化了
氧化了 。
。
假设2:0.1 mol/L 溶液中的
溶液中的 氧化了
氧化了 。
。
利用图2装置继续探究(已知:该装置中的电压大小反映了物质氧化性与还原性强弱的差异,物质氧化性与还原性强弱差异越大,电压越大)。
①将0.1 mol/L 溶液替换为
溶液替换为_______ 溶液,记录电压为 。
。
②上述实验证实了氧化 的物质中一定包含
的物质中一定包含 ,其证据是
,其证据是_______ 。
 和
和 的反应。
的反应。| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 | 0.1 mol/L  溶液( 溶液( ) ) | 0.1 mol/L  溶液( 溶液( ) ) | 出现黑色沉淀 |
 、
、 或Ag,设计实验验证。
或Ag,设计实验验证。已知:ⅰ.浓硝酸能将
 转化为
转化为 和
和 ;
;ⅱ.
 能溶解在浓氨水中形成银氨溶液,而
能溶解在浓氨水中形成银氨溶液,而 和Ag均不能。
和Ag均不能。①设计并进行如图1所示实验,证实黑色沉淀中含有
 。
。
试剂1和试剂2分别是
②设计并进行如下实验,证实黑色沉淀中不含有
 ,将实验操作和现象补充完整。
,将实验操作和现象补充完整。| 实验操作 | 实验现象 | |
| 步骤ⅰ | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
| 步骤ⅱ | 取少量洗涤后的黑色沉淀, |
(2)该实验小组同学认为
 溶液具有氧化性,在一定条件下能够氧化
溶液具有氧化性,在一定条件下能够氧化 ,设计实验进行探究,实验装置如图2所示。测得电压为
,设计实验进行探究,实验装置如图2所示。测得电压为 。对
。对 溶液中氧化
溶液中氧化 的物质进行推测。
的物质进行推测。假设1:0.1 mol/L
 溶液中的
溶液中的 氧化了
氧化了 。
。假设2:0.1 mol/L
 溶液中的
溶液中的 氧化了
氧化了 。
。利用图2装置继续探究(已知:该装置中的电压大小反映了物质氧化性与还原性强弱的差异,物质氧化性与还原性强弱差异越大,电压越大)。
①将0.1 mol/L
 溶液替换为
溶液替换为 。
。②上述实验证实了氧化
 的物质中一定包含
的物质中一定包含 ,其证据是
,其证据是
您最近一年使用:0次
名校
解题方法
5 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
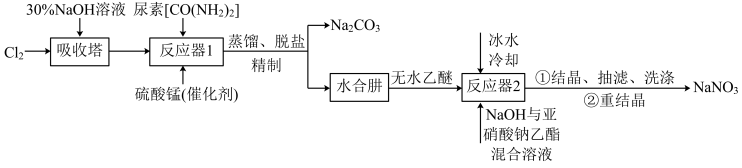
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为_______ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(3)反应器2中加入无水乙醚的作用是_______ 。
(4)已知亚硝酸乙酯的结构简式为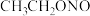 ,反应器2中生成
,反应器2中生成 和
和 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为_______ 。
(5)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(6)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
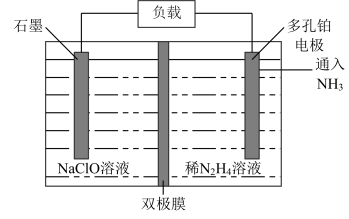
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为
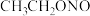 ,反应器2中生成
,反应器2中生成 和
和 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为(5)反应器1要控制NaClO溶液的用量,其主要目的是
(6)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
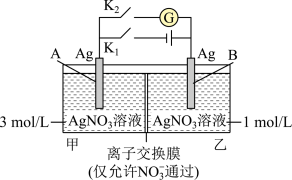

| A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等 |
| B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g |
| C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大 |
您最近一年使用:0次
2020-06-20更新
|
415次组卷
|
2卷引用:河北省石家庄市2020届高中毕业班综合训练(二)理综化学试题
名校
7 . 下列装置或操作一定能达到实验目的的是
| A | B | C | D |
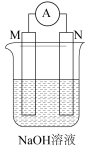 | 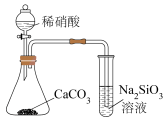 | 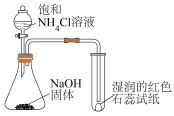 |  |
| 比较金属M和N的活动性 | 验证酸性: | 验证碱性:NaOH> | 验证氧化性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-12更新
|
196次组卷
|
2卷引用:湖北省2023届高三5月联考化学试题
解题方法
8 . ORP传感器(如下图)测定物质的氧化性的原理:将Pt电极插入待测溶液中,Pt电极、Ag/AgCl电极与待测溶液组成原电池,测得的电压越高,溶液的氧化性越强。向NaIO3溶液、FeCl3溶液中分别滴加2滴H2SO4溶液,测得前者的电压增大,后者的几乎不变。
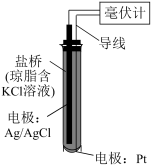
下列说法不正确 的是

下列说法
| A.盐桥中的Cl-移向Ag/AgCl电极 |
| B.Ag/AgCl电极反应是Ag-e-+Cl-=AgCl |
C.酸性越强, 的氧化性越强 的氧化性越强 |
| D.向FeCl3溶液中滴加浓NaOH溶液至碱性,测得电压几乎不变 |
您最近一年使用:0次
名校
解题方法
9 . 下列实验方案的设计能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证Cl2的氧化性强于Br2 | 向FeBr2溶液中通入少量Cl2 |
| B | 比较HF与HClO的酸性强弱 | 常温下,用pH计分别测定浓度为0.1 mol/L的NaF溶液和NaClO溶液的pH |
| C | 验证FeCl3与KI的反应是可逆反应 | 向1 mL0.1 mol/L FeCl3的溶液中滴加5 mL0.1mol/LKI溶液,充分反应后,取少量混合液滴加淀粉溶液 |
| D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
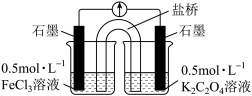
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1229次组卷
|
4卷引用:黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题
黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题



