名校
解题方法
1 . 用Cl2生产含氯有机物时会产生HCl。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。_____
(2)若将该反应设计成一原电池,则Cl2应在_____ (填“正极”或“负极”)附近逸出。
(3)上述反应中所有元素原子半径由大到小的顺序为_____ ;与氯元素同族的短周期元素原子最外层电子排布式为____ 。
(4)判断氯、溴非金属性强弱的依据是____ (选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是__ (选填序号)。
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.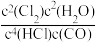 =K
=K
(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为___ 。
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线( =1,2,4,6)
=1,2,4,6)
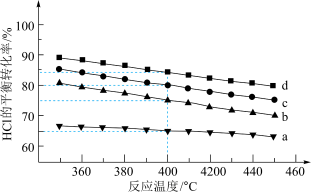
①曲线a对应的投料比
____ 。
②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有____ ;____ 。
利用反应__HCl(g)+__O2(g)⇌__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。
(2)若将该反应设计成一原电池,则Cl2应在
(3)上述反应中所有元素原子半径由大到小的顺序为
(4)判断氯、溴非金属性强弱的依据是
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.
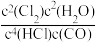 =K
=K(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线(
 =1,2,4,6)
=1,2,4,6)
①曲线a对应的投料比

②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有
您最近一年使用:0次
名校
解题方法
2 . 某小组研究SCN-分别与Cu2+和Fe3+的反应。
实验中:c(KSCN)=0.1mol/L;c[Fe2(SO4)3]=0.025mol/L;c(CuSO4)=0.05mol/L。
I.KSCN溶液与CuSO4溶液反应,实验如图:

资料:①Cu2+可与SCN-反应生成CuSCN白色沉淀和(SCN)2。
②(SCN)2也称为“拟卤素”,在水溶液中呈黄色;(SCN)2的化学性质与Cl2相似,可与水、碱等发生反应。
(1)a中产生白色沉淀的原因是____ (用离子方程式表示)。
(2)a→b中试管内溶液pH减小,可能的原因是____ 。
(3)b→c产生沉淀的原因是____ 。
II.同学们根据相同条件下氧化性:Fe3+>Cu2+,预测Fe3+与SCN—也可发生类似a中的氧化还原反应,进行如下实验:
(4)向Fe2(SO4)3溶液中滴入少量KSCN溶液,观察到____ ,表明发生了反应:Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
(5)基于(4)继续实验:用Fe2(SO4)3溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池,电压表指针几乎不偏转。该实验的目的是____ 。
(6)查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析a中反应发生的原因:生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是____ 。
(7)取(4)中反应后溶液,逐滴加入K3[Fe(CN)6]溶液,产生蓝色沉淀,并且沉淀量逐渐增多。该实验结果与(5)中实验结果不一致,解释原因:____ 。
(8)为进一步证实(7)中的解释,在以上实验的基础上补充实验,其操作及现象是____ 。
实验中:c(KSCN)=0.1mol/L;c[Fe2(SO4)3]=0.025mol/L;c(CuSO4)=0.05mol/L。
I.KSCN溶液与CuSO4溶液反应,实验如图:

资料:①Cu2+可与SCN-反应生成CuSCN白色沉淀和(SCN)2。
②(SCN)2也称为“拟卤素”,在水溶液中呈黄色;(SCN)2的化学性质与Cl2相似,可与水、碱等发生反应。
(1)a中产生白色沉淀的原因是
(2)a→b中试管内溶液pH减小,可能的原因是
(3)b→c产生沉淀的原因是
II.同学们根据相同条件下氧化性:Fe3+>Cu2+,预测Fe3+与SCN—也可发生类似a中的氧化还原反应,进行如下实验:
(4)向Fe2(SO4)3溶液中滴入少量KSCN溶液,观察到
 Fe(SCN)3。
Fe(SCN)3。(5)基于(4)继续实验:用Fe2(SO4)3溶液、KSCN溶液与石墨电极、电压表、盐桥等组装成原电池,电压表指针几乎不偏转。该实验的目的是
(6)查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析a中反应发生的原因:生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是
(7)取(4)中反应后溶液,逐滴加入K3[Fe(CN)6]溶液,产生蓝色沉淀,并且沉淀量逐渐增多。该实验结果与(5)中实验结果不一致,解释原因:
(8)为进一步证实(7)中的解释,在以上实验的基础上补充实验,其操作及现象是
您最近一年使用:0次
2020·北京·模拟预测
名校
解题方法
3 . 某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
【初步探究】
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________ 。
(2)写出实验③中 I-反应的离子方程式:_____________________ 。
(3)对比实验②③④,可以得出的结论:_______________________ 。
【继续探究】溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。

分析⑦和⑧中颜色无明显变化的原因_______ 。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
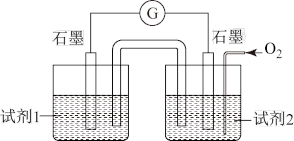
试剂1______________ 。 试剂2______________ 。实验现象:___________________________ 。
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________ 。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________ (写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________ 。
【初步探究】
| 示意图 | 序号 | 温度 | 试剂A | 现象 |
 | ① | 0°C | 0.5 mol∙L−1稀硫酸 | 4 min 左右出现蓝色 |
| ② | 20°C | 1 min 左右出现蓝色 | ||
| ③ | 20°C | 0.1 mol∙L−1稀硫酸 | 15 min 左右出现蓝色 | |
| ④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(2)写出实验③中 I-反应的离子方程式:
(3)对比实验②③④,可以得出的结论:
【继续探究】溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。

| 序号 | ⑤ | ⑥ | ⑦ | ⑧ |
| 试管中溶液的 pH | 8 | 9 | 10 | 11 |
| 放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。

试剂1
【深入探究】较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
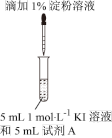
| 序号 | 温度 | 试剂 | 现象 |
| ⑨敞口试管 | 水浴 70°C | 5 mL 1 mol∙L−1 KI 溶液 5 mL 0.5 mol∙L−1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
| ⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
假设 1:
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因
您最近一年使用:0次
2020-05-02更新
|
595次组卷
|
3卷引用:《2020年新高考政策解读与配套资源》模拟试题02-2020年北京新高考化学模拟试题
(已下线)《2020年新高考政策解读与配套资源》模拟试题02-2020年北京新高考化学模拟试题北京市第八中学 2020届高三下学期化学自主测试三北京师范大学附属中学2022-2023学年高三上学期统练(VII)化学试题
4 . 下列实验装置能达到实验目的的是
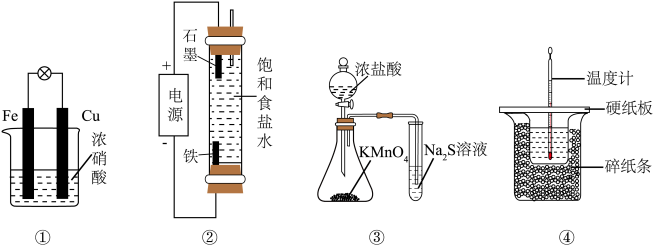
| A.装置①验证Fe和Cu的还原性强弱 | B.装置②制备少量NaClO |
C.装置③比较 、 、 和S的氧化性 和S的氧化性 | D.装置④测定中和反应的反应热 |
您最近一年使用:0次
名校
5 . 用下列装置进行相应实验,能达到实验目的的是
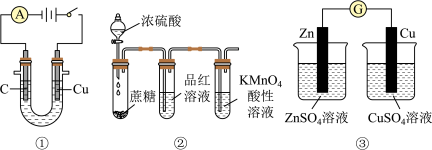



| A.图①所示装置可电解食盐水制氯气和氢气 |
B.图②所示装置可说明浓 具有脱水性、强氧化性, 具有脱水性、强氧化性, 具有氧化性、还原性 具有氧化性、还原性 |
| C.图③装置可以用来验证化学能转化为电能 |
D.用图4所示装置比较 、 、 、 、 的氧化性强弱 的氧化性强弱 |
您最近一年使用:0次
解题方法
6 . 已知反应 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:

①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中 棒上发生的反应为
棒上发生的反应为_________ ;
②过程中 棒上发生的反应为
棒上发生的反应为___________ 。
(2)操作②过程中,盐桥中的 移向
移向_________ 烧杯溶液(填“A”或“B”)。
资料: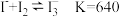 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入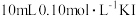 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
(3)a=________________ 。该平衡体系中除了含有 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒______________ (填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:
反应: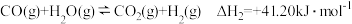
则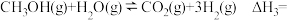
______________ 
(5)已知:25℃时,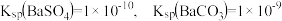 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量 仍然是安全的,
仍然是安全的, 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释):_________ 。误服少量 ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为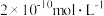 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为_______  。
。
 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入
 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。(1)①过程中
 棒上发生的反应为
棒上发生的反应为②过程中
 棒上发生的反应为
棒上发生的反应为(2)操作②过程中,盐桥中的
 移向
移向资料:
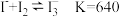 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入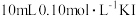 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:| 微粒 |  |  |  |
浓度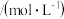 |  |  | a |
(3)a=
 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:

反应:
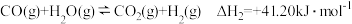
则
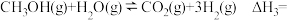

(5)已知:25℃时,
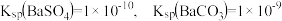 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量 仍然是安全的,
仍然是安全的, 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释): ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为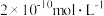 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为 。
。
您最近一年使用:0次
名校
解题方法
7 . 将铜棒插入浓、稀 溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓
溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓 溶液的铜棒变粗。下列说法不正确的是
溶液的铜棒变粗。下列说法不正确的是
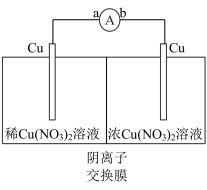
 溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓
溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓 溶液的铜棒变粗。下列说法不正确的是
溶液的铜棒变粗。下列说法不正确的是
A.铜棒变粗的反应: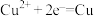 |
| B.导线中电子移动的方向:b→a |
C.随着反应的进行,浓、稀 溶液的浓度逐渐接近 溶液的浓度逐渐接近 |
D. 的氧化性随 的氧化性随 增大而增强,Cu的还原性随 增大而增强,Cu的还原性随 增大而减弱 增大而减弱 |
您最近一年使用:0次
2023-03-30更新
|
507次组卷
|
4卷引用:北京市朝阳区2023届高三一模考试化学试题
名校
解题方法
8 . 实验室探究 溶液与
溶液与 的反应。
的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是_______ 。
(2)写出C中制备 的离子方程式
的离子方程式_______ 。
II.探究 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。
a. 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_______ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图_______ 。
ii.写出B中的电极反应方程式中_______ 。
iii.请从反应原理的角度解释原因: 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀,_______ ,使 与
与 的反应能够反应完全。
的反应能够反应完全。
 溶液与
溶液与 的反应。
的反应。I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备
 的离子方程式
的离子方程式II.探究
 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入
 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。a.
 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 |  |  |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图
ii.写出B中的电极反应方程式中
iii.请从反应原理的角度解释原因:
 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀, 与
与 的反应能够反应完全。
的反应能够反应完全。
您最近一年使用:0次
名校
解题方法
9 . 现有M、N、P、E四种金属,已知:①氧化性强弱顺序为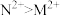 ;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为
;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为 ,
, 。则这四种金属的还原性由强到弱的顺序是
。则这四种金属的还原性由强到弱的顺序是
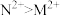 ;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为
;②E、P用导线连接放入稀硫酸中,P表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为 ,
, 。则这四种金属的还原性由强到弱的顺序是
。则这四种金属的还原性由强到弱的顺序是A.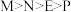 | B. |
C. | D.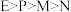 |
您最近一年使用:0次
2022-09-11更新
|
173次组卷
|
2卷引用:甘肃省白银市会宁县2021-2022学年高二上学期期末质量检测化学试题
解题方法
10 . 习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应:
与Cu2+的反应:

已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为___________ 。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度___________ (填“偏高”或“偏低”)。
(2)将操作2后生成的无色气体通入氯化铁溶液,___________ (填实验现象),说明该气体为SO2,反应的离子方程式为___________ 。
(3)操作2后生成的白色沉淀为___________ (填化学式),生成该沉淀和无色气体的反应离子方程式为___________ 。
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
,用图3装置(a、b均为石墨电极)进行实验验证。

①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加___________ ,a电极为___________ 极,产生的现象证实了其推测,其中不同于图1操作2后的现象是___________ 。
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与___________ 有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U形管左管添加___________ 。
 与Cu2+的反应:
与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为
(2)将操作2后生成的无色气体通入氯化铁溶液,
(3)操作2后生成的白色沉淀为
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及
 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与
您最近一年使用:0次



