1 . 硫元素在周期表中的位置是:第___________ 周期,___________ 族。
您最近一年使用:0次
解题方法
2 . 二硫化硒(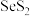 )具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。该物质中存在的化学键为
)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。该物质中存在的化学键为___________ ,已知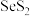 中硫元素的化合价为负价,请从原子结构角度解释原因:
中硫元素的化合价为负价,请从原子结构角度解释原因:___________ 。
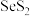 )具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。该物质中存在的化学键为
)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。该物质中存在的化学键为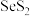 中硫元素的化合价为负价,请从原子结构角度解释原因:
中硫元素的化合价为负价,请从原子结构角度解释原因:
您最近一年使用:0次
解题方法
3 . 在“比较钠、镁、铝金属活泼性”实验中,甲、乙两组的实验如下:
(1)铝元素在元素周期表的位置________ 。
(2)写出钠和水反应的化学方程式,并用单线桥标出电子转移方向和数目________ 。有2.3g的钠完全反应,理论上标况下生成气体的体积________ 。
(3)下列实验依据可判断某元素的金属性强弱的是________。
(4)钠、镁、铝金属活泼性由强到弱顺序是________ ;甲、乙两组实验中,________ 组的实验更可靠,另一组不可靠的原因可能是________ 。
(5)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是_______。
| 甲组 | 乙组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。 将加入镁粉的试管加热至沸腾,观察现象。 | 钠:冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色。 镁:在冷水中几乎无现象,加热至沸产生大量气体,溶液变红。 | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象。 将加入镁粉的试管加热至沸腾,观察现象。 | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色。 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红。 |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象。 | 镁:剧烈反应,很快产生大量气体。 铝:也产生大量气体,但反应比镁慢。 | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象。 | 镁:开始时没有现象,过一会儿产生大量气体。 铝:基本没有变化。 |
(2)写出钠和水反应的化学方程式,并用单线桥标出电子转移方向和数目
(3)下列实验依据可判断某元素的金属性强弱的是________。
| A.导电性的强弱 | B.跟非金属反应生成化合物价态高低 |
| C.1mol该金属跟酸反应放出氢气的多少 | D.最高价氧化物对应水化物碱性的强弱 |
(5)元素周期表可以用于寻找新元素、发现物质的新用途。下列说法正确的是_______。
| A.在周期表中金属与非金属的分界处可以找到催化剂材料 |
| B.对氟、氯、硫、磷、砷等元素的研究,有助于制造出新品种的农药 |
| C.在过渡元素中可寻找制造半导体元素 |
| D.可在第IA、IIA族元素中寻找制造耐高温、耐腐蚀合金的元素 |
您最近一年使用:0次
4 . 钛元素Ti与81号铊元素TI的符号相似而被弄错,铊在元素周期表中的位置是___________ 。
您最近一年使用:0次
解题方法
5 . 华为 手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国芯片技术的飞速发展。
手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国芯片技术的飞速发展。
1.硅作为芯片的材料之一,其中硅元素位于周期表的第__________ 周期第__________ 族。
2.构成晶体硅的微粒种类是__________ ,其微粒间的作用力属于__________ 。
3.硅可作半导体材料的最主要原因是__________。
 手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国芯片技术的飞速发展。
手机于2023年8月底发售,它使用了高性能的国产芯片,体现了我国芯片技术的飞速发展。1.硅作为芯片的材料之一,其中硅元素位于周期表的第
2.构成晶体硅的微粒种类是
3.硅可作半导体材料的最主要原因是__________。
| A.硅元素地壳中含量巨大,仅次于氧元素 |
| B.硅元素位于周期表的金属与非金属的分界线附近 |
| C.硅单质性质稳定,无毒无害 |
| D.硅单质提纯技术成熟,制作成本较低 |
您最近一年使用:0次
解题方法
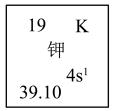
6 . 如图显示元素周期表中钾元素的部分信息,其中“39.10”表示________ 。
B.钾元素的相对原子质量
C.钾元素的原子序数
B.钾元素的相对原子质量
C.钾元素的原子序数
您最近一年使用:0次
解题方法
7 . 1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。元素周期表的意思远远超出了化学领域本身,他体现了科学规律的本质。如图是元素周期表的一部分,回答下列问题:
(1)元素周期表中位于金属和非金属的交界处,容易找到的元素是___________。
(2)已知核内有48个中子的硒元素的同位素,下列表示该核素的符号正确的是___________。
(3)硒 被誉为“生命的奇效元素”,下列关于硒的描述不正确的是___________。
被誉为“生命的奇效元素”,下列关于硒的描述不正确的是___________。
(4)人体内产生的活性氧能加速人体衰老,被称为“生命杀手”,化学家尝试用 清除人体内的活性氧,此时
清除人体内的活性氧,此时 表现出
表现出___________ 性。(填“氧化”或“还原”)
| B | C |  |  |
 |  |  |  |
 |  | 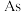 |  |
 |  |  |  |
 |  |  | 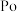 |
| A.制备农药的元素 | B.用于制作半导体材料的元素 |
| C.耐高温的合金元素 | D.制备催化剂的元素 |
A.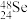 | B. | C.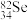 | D.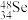 |
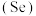 被誉为“生命的奇效元素”,下列关于硒的描述不正确的是___________。
被誉为“生命的奇效元素”,下列关于硒的描述不正确的是___________。| A.富硒大米中的“硒”指硒元素 | B.最高价氧化物是 |
| C.单质常温下呈固态 | D.硒原子最外层核外电子数为6 |
 清除人体内的活性氧,此时
清除人体内的活性氧,此时 表现出
表现出
您最近一年使用:0次
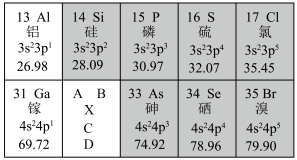
8 . 百余种不同的元素,是构成大千世界中所有物质的“基石”。科学家们根据元素性质的递变规律、电子排布的规律等对元素进行编排设计出元素周期表。下表是部分元素周期表。_______ ,原子半径:Ga_______ As(填“>”或“<”)。
2.半导体工业可以在硅芯片上集成上千亿根晶体管。碳和硅元素简单气态氢化物稳定性更强的_______ 。碳的最高价氧化物的电子式为_______ 。
3.硒(Se)被誉为“生命的奇效元素”,下列关于硒的描述不正确的是_______。
4.根据元素周期律,完成上表空白处X元素的信息填写。C_______ ,D_______ 。
2.半导体工业可以在硅芯片上集成上千亿根晶体管。碳和硅元素简单气态氢化物稳定性更强的
3.硒(Se)被誉为“生命的奇效元素”,下列关于硒的描述不正确的是_______。
| A.富硒大米中的“硒”指硒元素 | B.最高价氧化物是SeO2 |
| C.单质常温下呈固态 | D.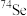 的质子数是34 的质子数是34 |
您最近一年使用:0次
名校
解题方法
9 . 元素周期表是指导我们系统学习化学的重要工具,如图是元素周期表的一部分。请回答以下问题: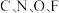 四种元素处于同一横行,是由于它们的
四种元素处于同一横行,是由于它们的___________ 数相同,卤族元素处于同一纵行,是由于它们的___________ 数相同。
A.电子层数 B.质子数 C.中子数 D.最外层电子数
(2)碘元素在元素周期表中的位置是___________ 。
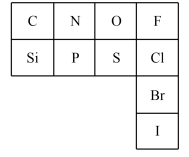
 四种元素处于同一横行,是由于它们的
四种元素处于同一横行,是由于它们的A.电子层数 B.质子数 C.中子数 D.最外层电子数
(2)碘元素在元素周期表中的位置是
您最近一年使用:0次
解题方法
10 . 百余种不同的元素,是构成大千世界中所有物质的“基石”。科学家们根据元素性质的递变规律、电子排布的规律等对元素进行编排设计出元素周期表。下表是部分元素周期表。______ ,原子半径:Ga______ As(填“>”或“<”)。
(2)半导体工业可以在硅芯片上集成上千亿根晶体管。碳和硅元素简单气态氢化物稳定性更强的是______ 。碳的最高价氧化物的电子式为______ .
(3)硒(Se)被誉为“生命的奇效元素”,下列关于硒的描述不正确 的是______。
(4)根据元素周期律,完成上表空白处 元素的信息填写。
元素的信息填写。
C______ D______
(5)氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。判断 的非金属性比
的非金属性比 强,可依据的事实是______。
强,可依据的事实是______。
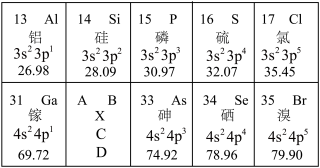
(2)半导体工业可以在硅芯片上集成上千亿根晶体管。碳和硅元素简单气态氢化物稳定性更强的是
(3)硒(Se)被誉为“生命的奇效元素”,下列关于硒的描述
| A.富硒大米中的“硒”指硒元素 | B.最高价氧化物是 |
| C.单质常温下呈固态 | D.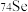 的质子数是34 的质子数是34 |
(4)根据元素周期律,完成上表空白处
 元素的信息填写。
元素的信息填写。C
(5)氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。判断
 的非金属性比
的非金属性比 强,可依据的事实是______。
强,可依据的事实是______。| A.氯气能溶于水,硫难溶于水 | B.常温下,氯单质呈气态,硫单质呈固态 |
C. 的酸性比 的酸性比 的强 的强 | D.氯气与氢硫酸能发生置换反应 |
您最近一年使用:0次



