20-21高二上·上海·课时练习
解题方法
1 . 在表中用实线画出周期表的外框,写明族序数和周期序数,并在相应的空格内写出1~20号元素的元素符号,用虚线画出过渡元素外框___ 。


您最近一年使用:0次
20-21高二上·上海·课时练习
2 . 下表是元素周期表的一部分:
(1)最高价氧化物对应的水化物中,碱性最强的是_______ ,酸性最强的是_______ 。
(2)f、g和h的气态氢化物的稳定性由强到弱的顺序是_______ 。
(3)研究发现,在元素周期表中左上方与右下方相邻元素也存在某些性质的相似性,这一规律通常称对角线规则或对角线相似,则与c呈对角线相似的元素是铍,元素符号是“Be”,如:Be与Al一样,也能与NaOH溶液反应,反应的化学方程式是:Be+2NaOH→Na2BeO2+H2↑。请根据以上信息,结合已学知识,尝试写出Be的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:_______ 。
| 周期/族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | a | |||||||
| 2 | d | e | h | |||||
| 3 | b | c | f | g |
(1)最高价氧化物对应的水化物中,碱性最强的是
(2)f、g和h的气态氢化物的稳定性由强到弱的顺序是
(3)研究发现,在元素周期表中左上方与右下方相邻元素也存在某些性质的相似性,这一规律通常称对角线规则或对角线相似,则与c呈对角线相似的元素是铍,元素符号是“Be”,如:Be与Al一样,也能与NaOH溶液反应,反应的化学方程式是:Be+2NaOH→Na2BeO2+H2↑。请根据以上信息,结合已学知识,尝试写出Be的最高价氧化物对应水化物与NaOH溶液反应的离子方程式:
您最近一年使用:0次
名校
3 . 为纪念 Dmitri Mendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会室布2019年是“国际化学元素周期表年。以下是元素周期表的一部分
回答下列问题:
(1)在上表中用实线画出元素周期表的上边界_______ 。
(2)元素X原子核外有_______ 种能量不同的电子,元素Y原子最外层电子的轨道表示式为_______ ;26号元素Z的最外层有2个电子,其原结构示意可以表示为_______ 。
(3)比较元素的金属性:X_______ Y(填“>”或“<),从原子结构的角度说明理由:_______ 。
(4)下列曲线分别表示元素的某种性质(y)与核电荷数(Z)的关系:

①若“y表示元素周期表中第一列元素单质熔点,则对应曲线的编号是_______ 。
②若“y”表示同一短周期元素的原子半径,则对应曲线的编号是_______ 。
(5)氮(N)元素的气态氢化物的电子式为_______ ,假设NH 是主族“元素”NH4的阳离子,则主族“元素”NH4在元素周期表中应处于第
是主族“元素”NH4的阳离子,则主族“元素”NH4在元素周期表中应处于第_______ 族,其“单质”在常温常压下_______ (填“能”或“不能”)导电。
| X | Y | ||||||||||||||||
| Z | |||||||||||||||||
(1)在上表中用实线画出元素周期表的上边界
(2)元素X原子核外有
(3)比较元素的金属性:X
(4)下列曲线分别表示元素的某种性质(y)与核电荷数(Z)的关系:

①若“y表示元素周期表中第一列元素单质熔点,则对应曲线的编号是
②若“y”表示同一短周期元素的原子半径,则对应曲线的编号是
(5)氮(N)元素的气态氢化物的电子式为
 是主族“元素”NH4的阳离子,则主族“元素”NH4在元素周期表中应处于第
是主族“元素”NH4的阳离子,则主族“元素”NH4在元素周期表中应处于第
您最近一年使用:0次
解题方法
4 . 在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是___________ (用元素符号表示)。同周期且金属性最强的元素位于周期表的第___________ 周期___________ 族,写出一种该元素与氯元素形成的化合物的用途___________ 。
您最近一年使用:0次
名校
5 . 氮化铝(AlN)是一种新型材料,硬度大、耐高温、耐腐蚀。
(1)Al在周期表中的位置是___ 。与Al同周期,金属性最强的是___ ,它的最高价氧化物对应水化物与Al的化学反应方程式为___ 。
(2)比较原子半径大小:r(N)___ r(F)(填>、<或=),写出F原子的结构示意图:___ ,写出N原子的电子式:___ 。
(3)请写出一条能证明F的非金属性比N强的事实:___ 。
(1)Al在周期表中的位置是
(2)比较原子半径大小:r(N)
(3)请写出一条能证明F的非金属性比N强的事实:
您最近一年使用:0次
名校
解题方法
6 . 前20号部分元素在周期表中的位置如下表:
回答问题:(均用元素符号表示)
(1)除(1)以外,原子半径最小的是_____ ,(4)(5)(6)(7)元素的简单离子中半径最大的离子是_____ 。
(2)相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是_____  。
。
(3)写出(11)离子的结构示意图________ 。
(4)从原子结构角度解释(12)比(13)金属性强的原因:_____________ 。
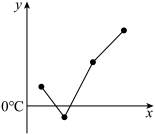
(5)单质沸点可能符合右图(x是原子序数,y是单质沸点)的四个元素是_______ 。
A. (2)(3)(4)(5) B. (8)(9)(10)(11) C. (5)(6)(7)(8) D. (10)(11)(12)(13)
| (1) | ||||||
| (2) | (3) | (4) | (5) | |||
| (6) | (7) | (8) | (9) | (10) | (11) | |
| (12) | (13) | |||||
回答问题:(均用元素符号表示)
(1)除(1)以外,原子半径最小的是
(2)相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是
 。
。
(3)写出(11)离子的结构示意图
(4)从原子结构角度解释(12)比(13)金属性强的原因:
(5)单质沸点可能符合右图(x是原子序数,y是单质沸点)的四个元素是
A. (2)(3)(4)(5) B. (8)(9)(10)(11) C. (5)(6)(7)(8) D. (10)(11)(12)(13)
您最近一年使用:0次
7 . 面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、 ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含
(2) 是
是 分子中的氢原子的类型有
分子中的氢原子的类型有
(3)NaClO的电子式
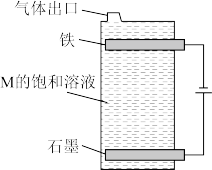
(4)①M的化学式
您最近一年使用:0次
名校
8 . 下表是元素周期律的一部分用元素符号或化学式、化学用语填空。
(1)在写出元素⑦的气态氢化物的电子式___ ;元素⑨的核外电子排布式为___ ;
(2)元素③的原子核外有___ 种能量不同的电子,有___ 种运动状态电子。
(3)元素⑧与⑥形成的晶体是___ 晶体:元素⑤和⑩形成的分子属于___ 分子(极性、非极性):
(4)写出元素②与④的最高价氧化物对应水化物之间反应的方程式___ ;
(5)元素⑨和⑩的非金属性比较更强___ (元素符号),用一个方程式说明这一结论___ 。
(6)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是___ (写编号)。
a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ⑤ | ⑦ | ⑧ | ||||
| 3 | ② | ③ | ④ | ⑥ | ⑨ | ⑩ |
(1)在写出元素⑦的气态氢化物的电子式
(2)元素③的原子核外有
(3)元素⑧与⑥形成的晶体是
(4)写出元素②与④的最高价氧化物对应水化物之间反应的方程式
(5)元素⑨和⑩的非金属性比较更强
(6)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
9 . 电气石是一种具有保健作用的天然石材,其中主要含有B、Si、Al、Mg、Na、O等元素。完成下面填空:
(1)上述元素中,原子半径最小的是________ (用元素符号表示,下同),在元素周期表中处于金属和非金属分界线附近的元素是____________ 。
(2)上述元素中,处于同一主族的两种元素,原子核外最外层有______ 种不同能级的电子,从表示原子结构的化学用语中选出最合适的用语描述这些不同能级的电子____________ 。
(3)B与最活泼的非金属元素形成的四核分子的化学式为________ ,已知该分子中所有的化学键长和键角都相等,据此_______ (填“能”或“不能”)判断该分子的极性。
(4)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,用电离方程式表示其原因:__________ 。
(1)上述元素中,原子半径最小的是
(2)上述元素中,处于同一主族的两种元素,原子核外最外层有
(3)B与最活泼的非金属元素形成的四核分子的化学式为
(4)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,用电离方程式表示其原因:
您最近一年使用:0次
2011·上海·零模
名校
10 . (1)原子核内无中子的元素可放在元素周期表的_____ 族,又根据最高正化合价和负化合价的绝对值相等可放在_____ 族,该元素还可放在元素周期表的_____ 族。它和氧元素可形成的化合物为________________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为_____ 。使水结成“热冰”采用“弱电场”的条件,说明水分子是 _______ 分子。
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式__________________________________________ ;该反应破坏的化学键是__________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式
您最近一年使用:0次



