解题方法
1 . 在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是___________ (用元素符号表示)。同周期且金属性最强的元素位于周期表的第___________ 周期___________ 族,写出一种该元素与氯元素形成的化合物的用途___________ 。
您最近一年使用:0次
名校
2 . 氮化铝(AlN)是一种新型材料,硬度大、耐高温、耐腐蚀。
(1)Al在周期表中的位置是___ 。与Al同周期,金属性最强的是___ ,它的最高价氧化物对应水化物与Al的化学反应方程式为___ 。
(2)比较原子半径大小:r(N)___ r(F)(填>、<或=),写出F原子的结构示意图:___ ,写出N原子的电子式:___ 。
(3)请写出一条能证明F的非金属性比N强的事实:___ 。
(1)Al在周期表中的位置是
(2)比较原子半径大小:r(N)
(3)请写出一条能证明F的非金属性比N强的事实:
您最近一年使用:0次
名校
解题方法
3 . 前20号部分元素在周期表中的位置如下表:
回答问题:(均用元素符号表示)
(1)除(1)以外,原子半径最小的是_____ ,(4)(5)(6)(7)元素的简单离子中半径最大的离子是_____ 。
(2)相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是_____  。
。
(3)写出(11)离子的结构示意图________ 。
(4)从原子结构角度解释(12)比(13)金属性强的原因:_____________ 。
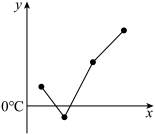
(5)单质沸点可能符合右图(x是原子序数,y是单质沸点)的四个元素是_______ 。
A. (2)(3)(4)(5) B. (8)(9)(10)(11) C. (5)(6)(7)(8) D. (10)(11)(12)(13)
| (1) | ||||||
| (2) | (3) | (4) | (5) | |||
| (6) | (7) | (8) | (9) | (10) | (11) | |
| (12) | (13) | |||||
回答问题:(均用元素符号表示)
(1)除(1)以外,原子半径最小的是
(2)相同物质的量的(4)和(10)的单质分别和(1)的单质化合时放出的热量最多的是
 。
。
(3)写出(11)离子的结构示意图
(4)从原子结构角度解释(12)比(13)金属性强的原因:
(5)单质沸点可能符合右图(x是原子序数,y是单质沸点)的四个元素是
A. (2)(3)(4)(5) B. (8)(9)(10)(11) C. (5)(6)(7)(8) D. (10)(11)(12)(13)
您最近一年使用:0次
4 . 面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、 ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含
(2) 是
是 分子中的氢原子的类型有
分子中的氢原子的类型有
(3)NaClO的电子式
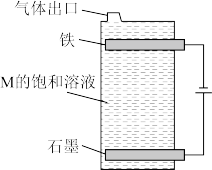
(4)①M的化学式
您最近一年使用:0次
名校
5 . 下表是元素周期律的一部分用元素符号或化学式、化学用语填空。
(1)在写出元素⑦的气态氢化物的电子式___ ;元素⑨的核外电子排布式为___ ;
(2)元素③的原子核外有___ 种能量不同的电子,有___ 种运动状态电子。
(3)元素⑧与⑥形成的晶体是___ 晶体:元素⑤和⑩形成的分子属于___ 分子(极性、非极性):
(4)写出元素②与④的最高价氧化物对应水化物之间反应的方程式___ ;
(5)元素⑨和⑩的非金属性比较更强___ (元素符号),用一个方程式说明这一结论___ 。
(6)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是___ (写编号)。
a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ⑤ | ⑦ | ⑧ | ||||
| 3 | ② | ③ | ④ | ⑥ | ⑨ | ⑩ |
(1)在写出元素⑦的气态氢化物的电子式
(2)元素③的原子核外有
(3)元素⑧与⑥形成的晶体是
(4)写出元素②与④的最高价氧化物对应水化物之间反应的方程式
(5)元素⑨和⑩的非金属性比较更强
(6)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
a.原子半径:Na<Cl b.离子半径:F-<Mg2+
c.热稳定性:HF>HCl d.碱性:NaOH>Mg(OH)2
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
6 . 电气石是一种具有保健作用的天然石材,其中主要含有B、Si、Al、Mg、Na、O等元素。完成下面填空:
(1)上述元素中,原子半径最小的是________ (用元素符号表示,下同),在元素周期表中处于金属和非金属分界线附近的元素是____________ 。
(2)上述元素中,处于同一主族的两种元素,原子核外最外层有______ 种不同能级的电子,从表示原子结构的化学用语中选出最合适的用语描述这些不同能级的电子____________ 。
(3)B与最活泼的非金属元素形成的四核分子的化学式为________ ,已知该分子中所有的化学键长和键角都相等,据此_______ (填“能”或“不能”)判断该分子的极性。
(4)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,用电离方程式表示其原因:__________ 。
(1)上述元素中,原子半径最小的是
(2)上述元素中,处于同一主族的两种元素,原子核外最外层有
(3)B与最活泼的非金属元素形成的四核分子的化学式为
(4)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,用电离方程式表示其原因:
您最近一年使用:0次
2011·上海·零模
名校
7 . (1)原子核内无中子的元素可放在元素周期表的_____ 族,又根据最高正化合价和负化合价的绝对值相等可放在_____ 族,该元素还可放在元素周期表的_____ 族。它和氧元素可形成的化合物为________________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为_____ 。使水结成“热冰”采用“弱电场”的条件,说明水分子是 _______ 分子。
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式__________________________________________ ;该反应破坏的化学键是__________ 。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

则A、B两幅图中能表示“热冰”的示意图为
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+),由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式
您最近一年使用:0次
2012·上海闵行·三模
8 . 碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)碳族元素位于元素周期表的___ ,从原子结构角度分析,它们的共同点是___ 。
(2)元素周期表中每一种元素都有具体信息,如图是碳元素的相关信息,其中“2s22p2”表示的是___ 。“12.01”是指___ (选填答案编号)

a.12C的相对原子质量 b.碳的摩尔质量
c.碳元素的相对原子质量 d.碳的质量数
(3)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为__ ,该晶体中微粒间的作用力是___ 。
(4)SiH4是___ (极性或非极性)分子,与CH4相比,其化学稳定性SiH4___ CH4(选填“<”、“>”)。
(1)碳族元素位于元素周期表的
(2)元素周期表中每一种元素都有具体信息,如图是碳元素的相关信息,其中“2s22p2”表示的是

a.12C的相对原子质量 b.碳的摩尔质量
c.碳元素的相对原子质量 d.碳的质量数
(3)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为
(4)SiH4是
您最近一年使用:0次
9 . 以氮化镓(GaN)、碳化硅、金刚石等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料。完成下列填空:
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是_______ 。原子序数最小的元素原子的核外电子排布式是___________ 。
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为______ 。
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
①写出氢氧化镓的电离方程式:______________ 。
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是___________ 。
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是_____ (选填编号)
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C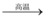 Si + 2CO↑
Si + 2CO↑
c.SiH4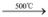 Si + 2H2;CH4
Si + 2H2;CH4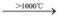 C + 2H2
C + 2H2
d.Si + O2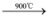 SiO2;C + O2
SiO2;C + O2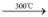 CO2
CO2
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
①写出氢氧化镓的电离方程式:
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C
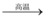 Si + 2CO↑
Si + 2CO↑c.SiH4
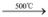 Si + 2H2;CH4
Si + 2H2;CH4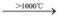 C + 2H2
C + 2H2d.Si + O2
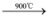 SiO2;C + O2
SiO2;C + O2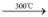 CO2
CO2
您最近一年使用:0次
10 . 与氯元素同周期且金属性最强的元素位于周期表的第____ 周期___ 族。与该元素相邻的短周期主族元素原子半径从大到小的顺序是_____ (用元素符号表示)
您最近一年使用:0次



