名校
1 . 铯(Cs)元素的原子结构示意图如图所示,请据此回答以下问题:

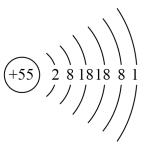
(1)铯在元素周期表中的位置是_______ 。
(2)从原子结构的角度比较并解释钠和铯元素的金属性强弱_______ 。


(1)铯在元素周期表中的位置是
(2)从原子结构的角度比较并解释钠和铯元素的金属性强弱
您最近一年使用:0次
名校
解题方法
2 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。Li位于周期表中_____ 区;基态Ti原子的价电子排布式为_____ ;基态Fe3+、Fe2+离子中未成对的电子数之比为_____ 。
您最近一年使用:0次
名校
3 . 为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、S、Hg、U”等元素的代言人。
(1)汞的原子结构示意图 ,汞在元素周期表中位于第
,汞在元素周期表中位于第_______ 周期。
(2)氮在周期表第_______ 列,周期表中位置是_______ 。
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
(4)非金属性:N>C,用一个化学方程式证明_______ 。
(1)汞的原子结构示意图
 ,汞在元素周期表中位于第
,汞在元素周期表中位于第(2)氮在周期表第
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
| A.酸性:HCl>H2S | B.非金属性:O>S |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:HCl>H2S |
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
4 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分:
回答下列问题:
(1)As元素在周期表中的位置是:___________ 。
(2)元素①气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(3)元素③、④、⑤的简单离子半径由大到小排序为:___________ (用离子符号表示)。
(4)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能( ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
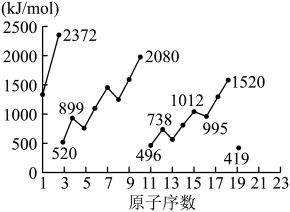
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(6)10号元素Ne的 值较大的原因是
值较大的原因是___________ 。
| ① | ② | ③ | ||
| ④ | P | ⑤ | ⑥ | |
| Ga | Ge | As | Se | Br |
回答下列问题:
(1)As元素在周期表中的位置是:
(2)元素①气态氢化物分子的空间构型是
(3)元素③、④、⑤的简单离子半径由大到小排序为:
(4)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能(
 ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.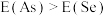 | B. | C. | D.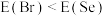 |
 值较大的原因是
值较大的原因是
您最近一年使用:0次
名校
5 . 下图是尚未完成的元素周期表,其中a、b、c、d、e、f为元素代号。_____
(2)在上图中用斜线阴影 标出过渡元素的范围。
标出过渡元素的范围。________
(3)在上图中用实线画出金属元素与非金属元素的分界线。________
(4)a原子在周期表中的位置是___________ ,写出a原子结构示意图___________ 。
(5)b和e两元素的原子以___________ (填化学键类型)形成化合物。
(6)b、c、d三种元素中,原子半径最大的是___________ (填元素名称),离子半径最大的是___________ (填离子符号)。
(7)写出c、d元素各自所形成的最高价氧化物对应的水化物之间发生的反应的离子方程式___________ 。
(8)b元素与其同主族元素的原子序数之差不可能是___________。
(9)下列有关元素周期表的叙述中,错误的是___________。

(2)在上图中用斜线阴影
 标出过渡元素的范围。
标出过渡元素的范围。(3)在上图中用实线画出金属元素与非金属元素的分界线。
(4)a原子在周期表中的位置是
(5)b和e两元素的原子以
(6)b、c、d三种元素中,原子半径最大的是
(7)写出c、d元素各自所形成的最高价氧化物对应的水化物之间发生的反应的离子方程式
(8)b元素与其同主族元素的原子序数之差不可能是___________。
| A.8 | B.16 | C.26 | D.44 |
| A.位于金属非金属分界线附近的元素既表现出金属的某些性质,又表现出非金属的某些性质 |
| B.人们在金属非金属分界线附近寻找高效催化剂 |
| C.元素b的最高价氧化物对应的水化物的酸性是最强的 |
| D.f是金属性最强的元素 |
您最近一年使用:0次
2023-05-01更新
|
236次组卷
|
2卷引用:上海市控江中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
6 . 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是______ 。
(2)In的最高价氧化物对应的水化物的碱性______ Ba(OH)2的碱性(填“>”或“<”)。
(3)硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。Se原子电子式可表示为______ 。
(4)下列说法合理的是______ 。
a.SeO2既有氧化性又有还原性 b.热稳定性:H2Se<HCl<H2S
c.酸性:H2SeO4<HBrO4<HClO4 d.Se比S更易与氢气反应
(1)In在周期表中的位置是
(2)In的最高价氧化物对应的水化物的碱性
(3)硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。Se原子电子式可表示为
(4)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.热稳定性:H2Se<HCl<H2S
c.酸性:H2SeO4<HBrO4<HClO4 d.Se比S更易与氢气反应
您最近一年使用:0次
名校
7 . 有H、C、O、Na、Mg、Al、P、Cl、Ar等9种元素或它们的原子。如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:(1)原子核对核外电子的吸引力(2)形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量( ):
):
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______ 。
(2)表中X可能为以上9种元素中的_______ (填写元素符号)元素。用元素符号表示X和地壳中含量占第一位的元素形成化合物的化学式_______ 。
(3)Y是周期表中_______ 族元素。
(4)以上9种元素中,_______ (填写字母)元素原子失去核外第一个电子需要的能量最多。
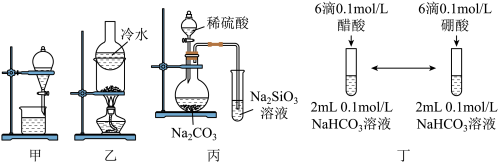
(5)下列实验装置符合题意且能达到相应实验目的的是_______。
 ):
):| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(2)表中X可能为以上9种元素中的
(3)Y是周期表中
(4)以上9种元素中,
(5)下列实验装置符合题意且能达到相应实验目的的是_______。

A.装置甲利用 提取苯中溶解的 提取苯中溶解的 |
B.装置乙分离 和 和 固体 固体 |
| C.装置丙验证非金属性S>C>Si(已知硅酸不溶于水) |
| D.装置丁比较醋酸与硼酸酸性(已知酸性醋酸>碳酸) |
您最近一年使用:0次
解题方法
8 . 如下图所示,甲、乙、丙常温下都为气体,2 mol甲反应生成1 mol丙和3 mol乙。
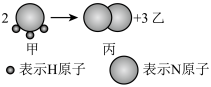
(1)同温同压下,生成丙和乙的体积比为_______ ,质量比为_______ 。
(2)甲分子的电子数为_______ ,丙元素在周期表中的位置是_______ 。

(1)同温同压下,生成丙和乙的体积比为
(2)甲分子的电子数为
您最近一年使用:0次
9 . 19世纪初,许多新的元素被相继发现,化学家开始关注这些元素在化学性质和物理性质上的相似性和递变性。1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)A原子的电子式为_______ ,B的氢化物的分子式为_______ ,C离子的结构示意图为_______ 。
(2)D的单质与水反应的化学方程式为_______ 。
| A | C | |
| B | D |
(2)D的单质与水反应的化学方程式为
您最近一年使用:0次
10 . 19世纪初,许多新的元素被相继发现,化学家开始关注这些元素在化学性质和物理性质上的相似性和递变性。1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。
(1)请写出下列元素在周期表中的位置:
Na_______ ; O_______ ;He_______ 。
(2)某元素位于第二周期第17族,它是_______ 元素(元素名称);与P相邻的同族元素的原子序数是_______ 、_______ 。
(1)请写出下列元素在周期表中的位置:
Na
(2)某元素位于第二周期第17族,它是
您最近一年使用:0次



