1 . 下表是元素周期表的一部分,针对元素①~⑥回答下列问题。
(1)④元素在周期表中的位置为_______ 。
(2)金属性最强的元素为_______ (填元素符号),其最高价氧化物对应的水化物中含有的化学键为_______ 。
(3)①③⑤三种元素对应的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(4)元素的非金属性⑥_______ Br(填“>”“<”或“=”),写出能证明该结论的离子方程式_______ 。
| ④ | ⑤ | ||||||
| ① | ③ | ⑥ | |||||
| ② | |||||||
(2)金属性最强的元素为
(3)①③⑤三种元素对应的简单离子半径由大到小的顺序为
(4)元素的非金属性⑥
您最近一年使用:0次
2 . 下表列出了①~④四种元素在周期表中的位置.
回答下列问题:
(1)①的元素符号为_____________ 。
(2)②的基态原子电子排布式为__________________________ 。
(3)③和④中原子半径较大的是_____________ (填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________ 形;每个p能级都有_____________ 个相互垂直的电子云。

| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ||||||
| 4 | ④ |
回答下列问题:
(1)①的元素符号为
(2)②的基态原子电子排布式为
(3)③和④中原子半径较大的是
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为

您最近一年使用:0次
解题方法
3 . 元素周期表与元素周期律在化学学习研究中有很重要的作用。下表是元素周期表的一部分
(1)写出④和⑨组成的化合物的电子式_______ ,⑧的简单离子结构示意图_______ 。
(2)元素①、②、⑦简单氢化物的稳定性最强的是_______ (用化学式表示)。
(3)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)_______ 。
(4)写出元素④、⑤最高价氧化物对应水化物相互反应的化学方程式_______ 。
(5)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)元素①、②、⑦简单氢化物的稳定性最强的是
(3)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)
(4)写出元素④、⑤最高价氧化物对应水化物相互反应的化学方程式
(5)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| A.比较两种单质的颜色 | B.比较两种单质与H2化合的难易程度 |
| C.依据两元素在周期表中的位置 | D.比较氧化物对应水化物的酸性强弱 |
您最近一年使用:0次
4 . 根据物质结构有关性质和特点,回答下列问题:
(1)钴位于元素周期表的___________ 。
(2)基态铝原子核外电子云轮廓图的形状有(填名称)___________ 。
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是___________ 。
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为___________ ;Fe3+比Fe2+更稳定的原因___________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________ 。
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为___________ ;
(1)钴位于元素周期表的
(2)基态铝原子核外电子云轮廓图的形状有(填名称)
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是_______ (填离子符号)。
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
您最近一年使用:0次
2022-04-04更新
|
400次组卷
|
2卷引用:四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题
名校
6 . 表中的实线表示元素周期表的部分边界。

(1)请在表中用实线补出元素周期表的上边界____ 。
(2)某主族元素原子的核外电子排布为: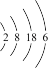 ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置____ 。
(3)元素Ⅰ的非金属性____ (填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,____ 。
(4)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式____ 。
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为: ,H3GO3分子中G原子
,H3GO3分子中G原子____ (填“是”或“不”)满足8电子稳定结构;H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为____ (填“酸式盐”或“正盐”)。

(1)请在表中用实线补出元素周期表的上边界
(2)某主族元素原子的核外电子排布为:
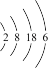 ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置(3)元素Ⅰ的非金属性
(4)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为:
 ,H3GO3分子中G原子
,H3GO3分子中G原子
您最近一年使用:0次
名校
7 . 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
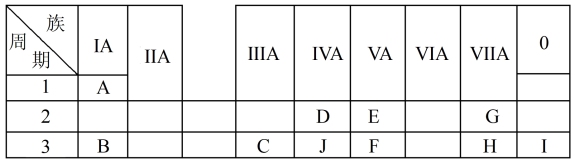
(1)表中元素,化学性质最不活泼的是_______ (填化学名称),只有负价而无正价的元素是_______ (填元素符号)。
(2)34号元素在元素周期表中的位置是_______ 。
(3)H最高价氧化物的化学式为_______ ,G和H氢化物中沸点更高的是_______ ,原因为:_______ 。
(4)A分别与E、G、H形成的化合物中,最稳定的是_______ 。
(5)在B、C、E、F中,原子半径最大的是_______ (填元素符号)。
(6)B、H两种元素所形成的化合物所含的化学键类型为_______ 。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:_______ 。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:_______ 。

(1)表中元素,化学性质最不活泼的是
(2)34号元素在元素周期表中的位置是
(3)H最高价氧化物的化学式为
(4)A分别与E、G、H形成的化合物中,最稳定的是
(5)在B、C、E、F中,原子半径最大的是
(6)B、H两种元素所形成的化合物所含的化学键类型为
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:
您最近一年使用:0次
解题方法
8 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图 ,汞在第
,汞在第___ 周期。
(2)NH3、H2O、H2S分别为氮、氧、硫3种元素对应的氢化物,其中沸点最高的是____ ,其中心原子杂化轨道类型:___ 。
(3)下列有关性质的比较能用元素周期律解释的是__ (填字母,下同)。
a.酸性:HCl>H2SO3
b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2
d.热稳定性:Na2CO3>NaHCO3
(4)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是___ 。
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(5)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
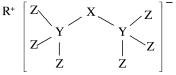
①R的元素符号为___ 。
②X的氢化物的电子式:___ 。
③写出Y的最高价氧化物的一种用途__ 。
(1)据汞的原子结构示意图
 ,汞在第
,汞在第(2)NH3、H2O、H2S分别为氮、氧、硫3种元素对应的氢化物,其中沸点最高的是
(3)下列有关性质的比较能用元素周期律解释的是
a.酸性:HCl>H2SO3
b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2
d.热稳定性:Na2CO3>NaHCO3
(4)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(5)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①R的元素符号为
②X的氢化物的电子式:
③写出Y的最高价氧化物的一种用途
您最近一年使用:0次
9 . 如图将元素周期表左侧对齐,每格代表一种元素。回答下列问题:

(1)表中元素⑤的最高化合价为_______ ,元素⑧的原子序数为_______ 。
(2)元素②、③、④的原子半径从大到小的顺序是_______ (用元素符号表示),元素⑤、⑦的单质中熔、沸点较高的是_______ (填分子式),解释熔、沸点较高的原因_______ 。
(3)高温灼烧由元素⑤、⑥组成的化合物时,火焰呈_______ 色。
(4)元素①与②组成含有18电子化合物的结构式为_______ ,其中共价键类型为_______ 。
(5)某种化合物由元素①、②、③组成,取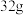 该化合物与足量元素④的单质反应,标况下生成
该化合物与足量元素④的单质反应,标况下生成
 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。

(1)表中元素⑤的最高化合价为
(2)元素②、③、④的原子半径从大到小的顺序是
(3)高温灼烧由元素⑤、⑥组成的化合物时,火焰呈
(4)元素①与②组成含有18电子化合物的结构式为
(5)某种化合物由元素①、②、③组成,取
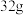 该化合物与足量元素④的单质反应,标况下生成
该化合物与足量元素④的单质反应,标况下生成
 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
名校
10 . 下图为元素周期表的一部分,该部分中8种元素的位置如图所示,试回答下列问题:

(1)②⑤⑦元素中,离子半径由大到小是_____ (填离子符号)。
(2)②③④三种元素最高价氧化物对应水化物的碱性最强的是_______ (填化学式)。
(3)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为_______ 。
(4)元素②和⑤的最高价氧化物对应水化物之间反应的化学方程式为_______ 。

(1)②⑤⑦元素中,离子半径由大到小是
(2)②③④三种元素最高价氧化物对应水化物的碱性最强的是
(3)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物对应水化物之间反应的化学方程式为
您最近一年使用:0次



