名校
1 . 下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
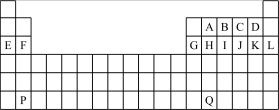
(1)在上表所列出的短周期元素中
①性质最不活泼的是____________ ;②原子半径最大的是(除稀有气体元素)__________ 。
③形成的气态氢化物最稳定的是______________________________ ;
④最高价氧化物对应的水化物中酸性最强的是____________ 碱性最强的是_____________ 。
⑤形成的阴离子还原性最弱的是_____________ ,阳离子半径最小的是_____________ 。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________ ;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________ 。
(3)设P的原子序数为Z,则F的原子序数为______________ ,Q的原子序数为________________ 。

(1)在上表所列出的短周期元素中
①性质最不活泼的是
③形成的气态氢化物最稳定的是
④最高价氧化物对应的水化物中酸性最强的是
⑤形成的阴离子还原性最弱的是
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为
②A单质与J的最高价氧化物对应的水化物反应的方程式
(3)设P的原子序数为Z,则F的原子序数为
您最近一年使用:0次
名校
2 . (1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________ 。

(2)部分短周期主族元素的原子半径及主要化合价
①乙元素的原子结构示意图____________ ,丙在元素周期表中的位置___________ ,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________ 。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________ ,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________ 。

(2)部分短周期主族元素的原子半径及主要化合价
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
| 原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
| 主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是
您最近一年使用:0次
2018-09-04更新
|
233次组卷
|
3卷引用:四川省凉山州2018-2019学年高一下学期期末考试化学试题
四川省凉山州2018-2019学年高一下学期期末考试化学试题福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2017-2018学年高一下学期期末联考化学试题(已下线)2019年3月3日 《每日一题》人教(必修2)-每周一测
名校
3 . 下图是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、h分别代表某种化学元素。请依据这8种元素回答下列问题。
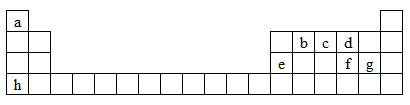
(1)上述8种元素的单质中常温下为气态,且密度最小的是______ (填化学式)。
(2)f元素的原子结构示意图为_______ 。
(3)c的最高价氧化物对应水化物的化学式为______ 。
(4)hg的电子式为_______ 。
(5)b、c、d三种元素的最简单氢化物的沸点由高到低的顺序是______ (填化学式)。
(6)元素e的单质与h的最高价氧化物对应的水化物反应的化学方程式为__________ 。
(7)f元素的最简单氢化物的水溶液显____ 性(填“酸”或“碱”),请写出该氢化物久置在空气中变质的化学方程式________ 。
(8)gd-常用作消毒剂,单质砷(As)在碱性溶液中可被gd-氧化为AsO43-,该反应的离子方程式为__________ 。

(1)上述8种元素的单质中常温下为气态,且密度最小的是
(2)f元素的原子结构示意图为
(3)c的最高价氧化物对应水化物的化学式为
(4)hg的电子式为
(5)b、c、d三种元素的最简单氢化物的沸点由高到低的顺序是
(6)元素e的单质与h的最高价氧化物对应的水化物反应的化学方程式为
(7)f元素的最简单氢化物的水溶液显
(8)gd-常用作消毒剂,单质砷(As)在碱性溶液中可被gd-氧化为AsO43-,该反应的离子方程式为
您最近一年使用:0次
2018-07-09更新
|
209次组卷
|
2卷引用:四川省宜宾市第四中学2019-2020学年高一下学期期末模拟考试化学试题
名校
4 . 短周期元素 a~g 在表中的位置如右表,请回答下列问题:
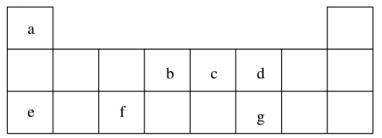
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
2017-10-21更新
|
707次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
13-14高三·四川成都·阶段练习
名校
5 . 二氧化氯是黄绿色的气体,可用于水体消毒与废水处理.一种制备方法为:
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是______ .
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)_____ g.
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是______ ,其中原子半径最大的元素最外层电子云形状为______ .
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与_______ 相同.(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:__________ .
(6)上述反应产物NaCl中含有______ 键,工业上用电解熔融的氯化钠制备金属钠,氯气在_____ (写电极名称)产生.
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:
(6)上述反应产物NaCl中含有
您最近一年使用:0次
2017-09-07更新
|
228次组卷
|
3卷引用:2015届四川省都江堰中学高三第三次理综考试化学试卷
名校
6 . 如表为元素周期表的一部分,标出了A—K共十种元素所在位置。请用元素符号或化学式 回答下列问题.
(1)10种元素中,化学性质最不活泼的是______ ,最活泼的金属是_____ 。
(2)C、E、F三种元素形成的简单离子半径最小的是_______ 。
(3)C、K形成的化合物中化学键的类型属于________ ,灼烧时火焰焰色为______ 。
(4)化合物C2B2的电子式为__________________ ;该化合物和AB2反应的化学方程式为__________________________________________ 。
(5)E的最高价氧化物属于________________ 性氧化物,它与氢氧化钠溶液反应的离子方程式为____________________________________________ 。
(6)D的单质在A、B形成化合物中燃烧的化学方程式为________________________ 。
(7)用电子式表示H与B组成的H2B型化合物的形成过程:_____________________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | A | B | ||||||
| 3 | C | D | E | F | G | |||
| 4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是
(2)C、E、F三种元素形成的简单离子半径最小的是
(3)C、K形成的化合物中化学键的类型属于
(4)化合物C2B2的电子式为
(5)E的最高价氧化物属于
(6)D的单质在A、B形成化合物中燃烧的化学方程式为
(7)用电子式表示H与B组成的H2B型化合物的形成过程:
您最近一年使用:0次
2017-07-07更新
|
210次组卷
|
2卷引用:四川省成都市成华区2016-2017学年高一下学期期末考试化学试题
7 . 铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________ ,基态铁原子价电子排布式为___________ 。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________ ,P、S元素第一电离能大小关系为_______________ 。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________ ;该配合物的熔点是170℃,则Ni(CO)n 属于 _______ 晶体。
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______ ,乙醇极易溶于水,其主要原因是_______________ 。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________ ,其晶胞边长为a cm,列式表示NiO晶体的密度为____ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。
(1)铁在元素周期表中的位置是
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为
您最近一年使用:0次
2017-07-01更新
|
482次组卷
|
2卷引用:四川省广安市2016-2017学年高二下学期期末考试化学试题
8 . A、B、C、D、E、F是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置_____________________ 。
(2)B的原子结构示意图_____________________ 。
(3)E元素形成最高价氧化物对应水化物的化学式为_____________________ 。
(4)元素C、D、E形成的原子半径大小关系是_____________________ (用元素符号表示).
(5)B、C的气态氢化物的稳定性关系为____________________ (填化学式)。
(6)C、D可形成原子个数比为1:1的化合物的电子式是_____________________ 。
(7)写出A、C、F三种元素按原子个数比1:1:1形成化合物的结构式______________ 。
(1)D在周期表中的位置
(2)B的原子结构示意图
(3)E元素形成最高价氧化物对应水化物的化学式为
(4)元素C、D、E形成的原子半径大小关系是
(5)B、C的气态氢化物的稳定性关系为
(6)C、D可形成原子个数比为1:1的化合物的电子式是
(7)写出A、C、F三种元素按原子个数比1:1:1形成化合物的结构式
您最近一年使用:0次
2017-07-01更新
|
376次组卷
|
2卷引用:四川省广安市2016-2017学年高一下学期期末考试化学试题
名校
9 . 下表列出了A-R9种元素在周期表中的位置:
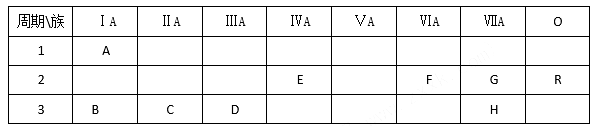
(1)这9种元素中B_______ ,D_______ ,E________ ,H________ 。
其中化学性质最不活泼的是_____________________ (以上均填元素符号)。
(2)B、C、D三种元素按原子半径由大到小的顺序排列为______________ (用元素符号表示).
(3)F元素简单氢化物的化学式是_____________ ,H元素跟B元素形成化合物的化学式是_______ ,高温灼烧该化合物时,火焰呈___________ 色。
(4)G元素和H元素两者核电荷数之差是___________ 。

(1)这9种元素中B
其中化学性质最不活泼的是
(2)B、C、D三种元素按原子半径由大到小的顺序排列为
(3)F元素简单氢化物的化学式是
(4)G元素和H元素两者核电荷数之差是
您最近一年使用:0次
10 . 下表是元素周期表短周期的一部分

(1)①~⑦元素中金属性最强的元素是___________ (用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________ 。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______ (填化学式)。
(4)表中元素②的单质与③的最高价含氧酸的浓溶液反应的化学方程式为___________________ 。
(5)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是_____________ ,属于______ 元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______ 。
(6)核内中子数为N的R ,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为
,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________ mol。

(1)①~⑦元素中金属性最强的元素是
(2)④与⑤形成的化合物的电子式为
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是
(4)表中元素②的单质与③的最高价含氧酸的浓溶液反应的化学方程式为
(5)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是
(6)核内中子数为N的R
 ,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为
,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为
您最近一年使用:0次



