1 . 下表列出了①~⑪111种元素在元素周期表中的位置:
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩⑪的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因_______________________
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
| 一 | ① | ||||||||||
| 二 | ② | ③ | ④ | ⑤ | |||||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
| 四 | ⑪ | ||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)
(4)元素⑨⑩⑪的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
您最近一年使用:0次
2020-01-16更新
|
166次组卷
|
2卷引用:四川省南充市西华师范大学附属中学2022-2023学年高一上学期期末考试化学试题
名校
2 . 下表是元素周期表的一部分,根据A~H在元素周期表中的位置,用元素符号或化学式回答下列问题:
(1)上表中,元素金属性最强的是________ (填元素符号)。
(2)写出D的原子结构示意图:__________
(3)B与C的原子半径比较:B________ C (填“>”或“<”)。G与H的非金属性比较:G ________ H(填“>”或“<”)。
(4)A与H形成化合物的电子式:_______
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | F | H |
(1)上表中,元素金属性最强的是
(2)写出D的原子结构示意图:
(3)B与C的原子半径比较:B
(4)A与H形成化合物的电子式:
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:
您最近一年使用:0次
2019-09-21更新
|
286次组卷
|
4卷引用:四川省成都实验中学2020-2021学年度高2022届高二上学期开学考试化学试题
四川省成都实验中学2020-2021学年度高2022届高二上学期开学考试化学试题湖南省张家界市2018-2019学年高一下学期期末考试化学试题湖北省沙市中学2019-2020学年高二上学期期中考试化学(学考)试题(已下线)专题09 元素周期律(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学
名校
3 . 标号为①~⑩的元素,在元素周期表中的位置如下:
试回答下列问题:
(1)(填写元素符号)①_____ ③______ ⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式为________ ,用电子式表示其形成过程为__________ 。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:______ ﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________ ,在该化合物中既含有________ 键,又含有________ 键。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)①
(2)①和④号元素形成的化合物的化学式为
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:
(4)①、⑤、⑦号元素形成的一种化合物的电子式是
您最近一年使用:0次
2019-08-09更新
|
584次组卷
|
4卷引用:四川省宜宾市第四中学校2019-2020学年高一下学期第二次月考化学试题
名校
4 . 下表是元素周期表的一部分,针对表中的①~⑧中元素,回答以下问题:
(1)在③~⑦元素中,原子半径最大的是__________ 用元素符号或化学式填空,下同),其离子的原子结构示意图为________ 。
(2)元素的最高价氧化物对应的水化物中酸性最强的是_____ ;碱性最强的是______ ,写出该物质和呈两性的氢氧化物的化学反应方程式____________________ ;
(3)在以上元素的单质中,化学性质最不活泼的是____ 。
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在③~⑦元素中,原子半径最大的是
(2)元素的最高价氧化物对应的水化物中酸性最强的是
(3)在以上元素的单质中,化学性质最不活泼的是
您最近一年使用:0次
2019-06-12更新
|
95次组卷
|
2卷引用:四川省泸州市泸县第五中学2021-2022学年高一下学期第一次月考试化学试题
名校
5 . 按要求填空:
(1)某原子含有 6 个质子和 8 个中子,用核素符号表示该原子__________ ;(用元素符号表示)
(2)写电子式:HClO:____ ;NH4+:_____ ;写结构式:CCl4:_____ ;CS2:_____ ;
(3)画出钙原子的原子结构示意图:____ ;画出溴离子的离子结构示意图:____ ;
(4)用电子式表示氯化钠的形成过程:_________________________
(5)按要求排序:
下列离子半径由大到小的顺序是:S2- ;Al3+ ;Na+ ;F- ;______________
下列物质熔沸点由高到低的顺序是:H2O;Na2O;H2Se;I2 ;______________
(1)某原子含有 6 个质子和 8 个中子,用核素符号表示该原子
(2)写电子式:HClO:
(3)画出钙原子的原子结构示意图:
(4)用电子式表示氯化钠的形成过程:
(5)按要求排序:
下列离子半径由大到小的顺序是:S2- ;Al3+ ;Na+ ;F- ;
下列物质熔沸点由高到低的顺序是:H2O;Na2O;H2Se;I2 ;
您最近一年使用:0次
名校
6 . 如图是元素周期表的一部分。
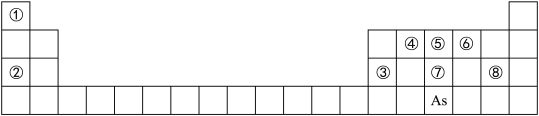
(1)②、⑥、⑧的离子半径由大到小的顺序为____________ (用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________ 其氢化物的化学式为__________ ;
(4)Y由②、⑥、⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________ ,当消耗l mol还原剂时,电子转移了_____ mol。

(1)②、⑥、⑧的离子半径由大到小的顺序为
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)As的原子结构示意图为
(4)Y由②、⑥、⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
您最近一年使用:0次
2019-05-10更新
|
187次组卷
|
2卷引用:四川省棠湖中学2019-2020学年高一下学期期中考试化学试题
名校
7 . 下表是元素周期表短周期的一部分:
请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________ ;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序:_____________________ ;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________ ;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________ ;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________ ,若将其溶于水,破坏了其中的__________ (填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4 :1反应的离子方程式________ 。

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序:
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程
(4)比元素⑦的原子序数多17的元素在周期表的位置为
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4 :1反应的离子方程式
您最近一年使用:0次
2019-05-09更新
|
2348次组卷
|
3卷引用:四川省彭州市濛阳中学2019-2020学年高二下学期开学考试化学试题
名校
8 . 下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
(1)写出下列序号所代表的元素符号③_____ ;⑩______
(2)写出⑥的一种用途_________________ ;常温下可与表中_______ 单质反应(填化学式)
(3)元素④的原子结构示意图为________________________ ;
(4)⑤和⑨形成的化合物的化学式为:_____________ ;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________ .
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________ (用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑧ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
| 4 | ② | ④ |
(1)写出下列序号所代表的元素符号③
(2)写出⑥的一种用途
(3)元素④的原子结构示意图为
(4)⑤和⑨形成的化合物的化学式为:
(5)②⑤⑦⑧的原子半径由大到小的顺序是
(6)将①⑤同时投入到水中,发生反应的化学方程式有:
您最近一年使用:0次
2019-04-16更新
|
280次组卷
|
2卷引用:四川省棠湖中学2018-2019学年高一下学期期末模拟化学试题
名校
9 . I.下面是7×18的格子,按要求作答。

(1)用封闭的实线绘出元素周期表的轮廓。_______________
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大、温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素,已知这种元素的一种核素没有中子。你由此可知最先产生的元素是________ (填写元素名称),该元素的另一种核素,其中子数比质子数多1,此种核素的原子符号是________ 。
(3)C、D、E、F的简单离子半径由小到大的顺序是____________ (填写离子符号)。
(4)请用电子式表示出E和H组成的化合物的形成过程:_________________ 。
(5)用实线绘出金属与非金属的分界线;用实线绘出过渡元素的分界线。_____________
(6)请写出B形成的单质与氢气反应的化学方程式:______________ 。
(7)下列各种叙述中,正确的是__________ 。
a.化学键可分为离子键、共价键、极性键和非极性键四种类型
b.由非金属元素组成的化合物不一定是共价化合物
c.非极性键只存在于双原子单质分子里
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,可以说明氯元素的非金属性比硫元素强
e.卤素氟、氯、溴、碘的氢化物的沸点由低到高的顺序为:HF<HCl<HBr<HI
f.构成单质分子的粒子不一定含有共价键

(1)用封闭的实线绘出元素周期表的轮廓。
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大、温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素,已知这种元素的一种核素没有中子。你由此可知最先产生的元素是
(3)C、D、E、F的简单离子半径由小到大的顺序是
(4)请用电子式表示出E和H组成的化合物的形成过程:
(5)用实线绘出金属与非金属的分界线;用实线绘出过渡元素的分界线。
(6)请写出B形成的单质与氢气反应的化学方程式:
(7)下列各种叙述中,正确的是
a.化学键可分为离子键、共价键、极性键和非极性键四种类型
b.由非金属元素组成的化合物不一定是共价化合物
c.非极性键只存在于双原子单质分子里
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,可以说明氯元素的非金属性比硫元素强
e.卤素氟、氯、溴、碘的氢化物的沸点由低到高的顺序为:HF<HCl<HBr<HI
f.构成单质分子的粒子不一定含有共价键
您最近一年使用:0次
2019-04-09更新
|
294次组卷
|
2卷引用:【全国百强校】四川省成都市第七中学2018-2019学年高一下学期3月月考化学试题
名校
10 . 填写下列空白:
(1)已知某原子的核内有77个质子,质量数为191,则其核内的中子数为_________ 。
(2)周期表中位于第8纵行的铁元素属于第________ 族。
(3)周期表中最活泼的非金属元素位于第_____________ 纵行。
(4)所含元素为18种的周期是第____________ 周期。
(5)4g D2和20g 18O的单质化合时最多能生成_______ g D2O,这些D2O分子中含___ mol中子。
(6)氯元素在自然界中有质量数为35和37的两种核素,氯元素的相对原子质量为35.5,则两核素在自然界中的含量之比约为______________ 。
(1)已知某原子的核内有77个质子,质量数为191,则其核内的中子数为
(2)周期表中位于第8纵行的铁元素属于第
(3)周期表中最活泼的非金属元素位于第
(4)所含元素为18种的周期是第
(5)4g D2和20g 18O的单质化合时最多能生成
(6)氯元素在自然界中有质量数为35和37的两种核素,氯元素的相对原子质量为35.5,则两核素在自然界中的含量之比约为
您最近一年使用:0次



