1 . 下表是元素周期表的一部分,回答下列问题。

(1)⑨在周期表中的位置是__________________________ ;
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是______________ ;
(3)①⑤两元素可以形成原子个数比1︰1和2︰1的化合物X和Y,其中X的电子式为__________ ,用电子式表示Y的形成过程______________________________________ ;
(4)实验室制取④的最简单氢化物的化学反应方程式是:______________________________ ;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,写出Z发生催化氧化的反应方程式:_________________________________________________ 。

(1)⑨在周期表中的位置是
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是
(3)①⑤两元素可以形成原子个数比1︰1和2︰1的化合物X和Y,其中X的电子式为
(4)实验室制取④的最简单氢化物的化学反应方程式是:
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,写出Z发生催化氧化的反应方程式:
您最近一年使用:0次
2 . 短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____ ;
(2)B、C 易形成淡黄色化合物,其电子式为____ ,该物质含有的化学键 类型为_____ ;
(3)用电子式表示 DF2 的形成过程____ ;
(4)元素 E、F 中非金属性较强的是____ ,请用一个置换反应证明____ (写化学反应方程式);
(5)原子半径:C____ E;熔点:DB____ CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____ ;含 A元素的化合物在是自然界种类最多的原因是____ 。
(1)D 在周期表中的位置
(2)B、C 易形成淡黄色化合物,其电子式为
(3)用电子式表示 DF2 的形成过程
(4)元素 E、F 中非金属性较强的是
(5)原子半径:C
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称 是______ ,碱性最强的化合物的化学式 是_______ 。
(2)⑤⑦形成化合物的电子式___ 。②形成的最高价氧化物的结构式____ 。
(3)最高价氧化物是两性氧化物的元素 其元素符号是____ ;写出它的氢氧化物与 ⑧的最高价氧化物的水化物反应的离子方程式
⑧的最高价氧化物的水化物反应的离子方程式________ 。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______ 。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________ 。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的
(2)⑤⑦形成化合物的电子式
(3)最高价氧化物是两性氧化物的
 ⑧的最高价氧化物的水化物反应的离子方程式
⑧的最高价氧化物的水化物反应的离子方程式(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:
您最近一年使用:0次
2017-04-14更新
|
265次组卷
|
3卷引用:2016-2017学年四川省成都市九校高一下学期期中联考化学试卷
名校
4 . 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
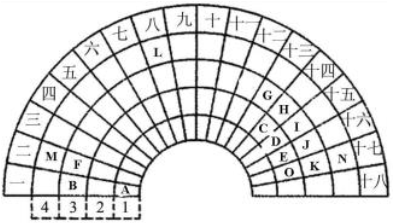
(1)L元素在常见周期表中所处的位置是________ ,其单质与A2E反应的化学方程式为____________ 。
(2)元素F、G、J、K、M对应简单离子的离子半径由大到小的顺序是(用离子符号表示)___________ 。
(3)用电子式表示MO2的形成过程:_______________ 。
(4)B、F、G三种元素最高价氧化物对应的水化物碱性最强的是__________ (填化学式)。比较元素C和J的非金属性强弱:C______ J(填“强于”或“弱于”)。
(5)向元素B和N形成的化合物的水溶液中,加入元素K的单质,所发生的反应的离子方程式为_____ ;反应后,向溶液中加入C、K形成的化合物,现象为___________ 。
(6)均由A、B、E、J四种元素组成的两种化合物可相互反应,写出反应的化学方程式______________ 。

(1)L元素在常见周期表中所处的位置是
(2)元素F、G、J、K、M对应简单离子的离子半径由大到小的顺序是(用离子符号表示)
(3)用电子式表示MO2的形成过程:
(4)B、F、G三种元素最高价氧化物对应的水化物碱性最强的是
(5)向元素B和N形成的化合物的水溶液中,加入元素K的单质,所发生的反应的离子方程式为
(6)均由A、B、E、J四种元素组成的两种化合物可相互反应,写出反应的化学方程式
您最近一年使用:0次
名校
5 . 填空题
(1)H、D、T三种原子,它们之间的关系是_________ ;在标准状况下,它们的单质的密度之比为_____ ;1 mol各单质中,它们的质子数之比为________ ;在标准状况下,1L各种单质中,它们的电子数之比为________ 。
(2)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是_____ ,属于______ 元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______ 。
(3)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(A~G)填入相应的空格中:
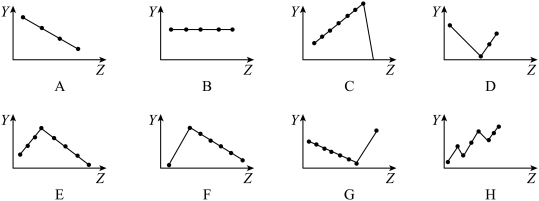
①IIA族元素的价电子数________ ;
②第三周期元素的最高正化合价________ ;
③VIIA族元素氢化物的沸点____________ 。
(4)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为_____ mol。
①若R为钙元素,且N=19,则采用原子符号的表达方式,可将R2+表示为_______ ;
②若R为第五周期IIA元素,则其硫酸盐______ 于水(填“溶”或“不溶”)。
(1)H、D、T三种原子,它们之间的关系是
(2)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是
(3)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(A~G)填入相应的空格中:

①IIA族元素的价电子数
②第三周期元素的最高正化合价
③VIIA族元素氢化物的沸点
(4)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为
①若R为钙元素,且N=19,则采用原子符号的表达方式,可将R2+表示为
②若R为第五周期IIA元素,则其硫酸盐
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素名称:
A_________ ,B_________ ,C________ ,D_______ ,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:_______________
(3)写出A的最高价氧化物对应水化物与B对应元素单质反应的化学方程式:__________________
(4)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示)_____________________
(1)写出下列元素名称:
A
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A的最高价氧化物对应水化物与B对应元素单质反应的化学方程式:
(4)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示)
您最近一年使用:0次
2016-12-09更新
|
187次组卷
|
2卷引用:四川省西华师范大学附属巴中实验中学(巴中市第五中学)2020-2021学年高一下学期3月月考化学试题
解题方法
7 . C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________ 。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________ 。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l
2 NO(g) +O2(g) 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g) SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=___________ kJ·mol-l
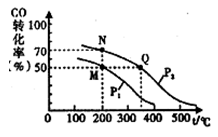
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g) CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为_______ ;Pl_______ P2(填“>、<或=”);平衡常数KM=__________ 。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为____________ 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是________ 。
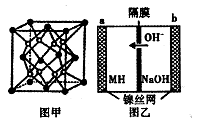
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
(1)N元素在元素周期表中的位置是
(2) H2S的沸点比H2O的沸点低的主要原因是
(3)已知:2 SO2(g) +O2(g)-
 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l2 NO(g) +O2(g)
 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l则反应NO2(g) +SO2(g)
 SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)
 CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为
 Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
您最近一年使用:0次
8 . 假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可排元素种类如下:
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是________________ 。
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有___________ 种非金属元素,还有__________ 种未发现。未发现的非金属元素处于__________ 周期_________ 族。
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
①请在图中将过渡元素所在的位置涂黑______________ 。
②画出B元素价电子排布图____________________ 。
(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
①请在图中将过渡元素所在的位置涂黑
②画出B元素价电子排布图
您最近一年使用:0次
2016-12-09更新
|
241次组卷
|
3卷引用:2015-2016学年四川省雅安市天全中学高二9月月考化学试卷
2015-2016学年四川省雅安市天全中学高二9月月考化学试卷2017届湖北省老河口市江山中学高三10月月考化学卷(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
13-14高一下·陕西延安·期末
9 .
(1)按已知的原子结构规律,82号元素X应是第___________ 周期_________ 族元素,它的最高正价氧化物的化学式为______________ 。
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2·8H2O与NH4Cl,属于放热反应_________ 填序号),写出反应⑥的化学方程式__________ 。
(3)在下列化合物中:H2O2、Na2O、、I2、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是_________ ,
②只有极性共价键的共价化合物是________ ,
③只含有非极性共价键的是_____ ,
④既有离子键又有非极性键的化合物是_____________ 。
(1)按已知的原子结构规律,82号元素X应是第
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2·8H2O与NH4Cl,属于放热反应
(3)在下列化合物中:H2O2、Na2O、、I2、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是
②只有极性共价键的共价化合物是
③只含有非极性共价键的是
④既有离子键又有非极性键的化合物是
您最近一年使用:0次
11-12高一下·河北邢台·阶段练习
名校
10 . 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
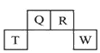
(1)T的原子结构示意图为______________________ 。
(2)元素的非金属性(原子的得电子能力):Q_______________ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为__________________________________ 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________________ 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是______________ 。

(1)T的原子结构示意图为
(2)元素的非金属性(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是
您最近一年使用:0次
2016-12-09更新
|
241次组卷
|
10卷引用:四川省南充市白塔中学2021-2022学年高一下学期期中考试化学试题
四川省南充市白塔中学2021-2022学年高一下学期期中考试化学试题(已下线)2011-2012学年河北省邢台一中高一下学期第二次月考化学试卷2014-2015福建省福州市第八中学高一下学期期中化学试卷2015-2016学年海南琼海市嘉积中学高一下期中理科化学卷2016-2017学年河北省邯郸市大名县第一中学高一3月月考化学试卷2016-2017学年河南省林州市第一中学高一3月调研考试化学试卷江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题江苏省泰州中学2016-2017学年高一5月月度检测化学试题山东省潍坊市临朐县实验中学2022届高三9月摸底考试化学试题安徽省砀山县第四中学2021-2022学年高一下学期第一阶段教学质量检测 化学试题



