名校
1 . 表中的实线表示元素周期表的部分边界。

(1)请在表中用实线补出元素周期表的上边界____ 。
(2)某主族元素原子的核外电子排布为: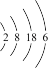 ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置____ 。
(3)元素Ⅰ的非金属性____ (填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,____ 。
(4)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式____ 。
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为: ,H3GO3分子中G原子
,H3GO3分子中G原子____ (填“是”或“不”)满足8电子稳定结构;H3GO3与过量氢氧化钠溶液反应生成的产物Na2HGO3为____ (填“酸式盐”或“正盐”)。

(1)请在表中用实线补出元素周期表的上边界
(2)某主族元素原子的核外电子排布为:
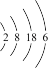 ,该元素在元素周期表中的位置
,该元素在元素周期表中的位置(3)元素Ⅰ的非金属性
(4)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质,写出D(OH)2与氢氧化钠溶液反应的化学方程式
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为:
 ,H3GO3分子中G原子
,H3GO3分子中G原子
您最近一年使用:0次
名校
2 . 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
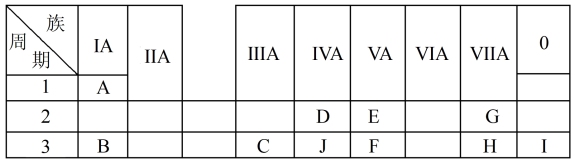
(1)表中元素,化学性质最不活泼的是_______ (填化学名称),只有负价而无正价的元素是_______ (填元素符号)。
(2)34号元素在元素周期表中的位置是_______ 。
(3)H最高价氧化物的化学式为_______ ,G和H氢化物中沸点更高的是_______ ,原因为:_______ 。
(4)A分别与E、G、H形成的化合物中,最稳定的是_______ 。
(5)在B、C、E、F中,原子半径最大的是_______ (填元素符号)。
(6)B、H两种元素所形成的化合物所含的化学键类型为_______ 。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:_______ 。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:_______ 。

(1)表中元素,化学性质最不活泼的是
(2)34号元素在元素周期表中的位置是
(3)H最高价氧化物的化学式为
(4)A分别与E、G、H形成的化合物中,最稳定的是
(5)在B、C、E、F中,原子半径最大的是
(6)B、H两种元素所形成的化合物所含的化学键类型为
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:
您最近一年使用:0次
3 . 如图将元素周期表左侧对齐,每格代表一种元素。回答下列问题:

(1)表中元素⑤的最高化合价为_______ ,元素⑧的原子序数为_______ 。
(2)元素②、③、④的原子半径从大到小的顺序是_______ (用元素符号表示),元素⑤、⑦的单质中熔、沸点较高的是_______ (填分子式),解释熔、沸点较高的原因_______ 。
(3)高温灼烧由元素⑤、⑥组成的化合物时,火焰呈_______ 色。
(4)元素①与②组成含有18电子化合物的结构式为_______ ,其中共价键类型为_______ 。
(5)某种化合物由元素①、②、③组成,取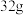 该化合物与足量元素④的单质反应,标况下生成
该化合物与足量元素④的单质反应,标况下生成
 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。

(1)表中元素⑤的最高化合价为
(2)元素②、③、④的原子半径从大到小的顺序是
(3)高温灼烧由元素⑤、⑥组成的化合物时,火焰呈
(4)元素①与②组成含有18电子化合物的结构式为
(5)某种化合物由元素①、②、③组成,取
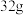 该化合物与足量元素④的单质反应,标况下生成
该化合物与足量元素④的单质反应,标况下生成
 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
名校
4 . 下图为元素周期表的一部分,该部分中8种元素的位置如图所示,试回答下列问题:

(1)②⑤⑦元素中,离子半径由大到小是_____ (填离子符号)。
(2)②③④三种元素最高价氧化物对应水化物的碱性最强的是_______ (填化学式)。
(3)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为_______ 。
(4)元素②和⑤的最高价氧化物对应水化物之间反应的化学方程式为_______ 。

(1)②⑤⑦元素中,离子半径由大到小是
(2)②③④三种元素最高价氧化物对应水化物的碱性最强的是
(3)元素⑦的简单氢化物与元素⑧的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物对应水化物之间反应的化学方程式为
您最近一年使用:0次
名校
5 . 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
(1)C元素在周期表中的位置为_______ ,其离子结构示意图为:_______
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为_______
(3)关于C、D 两种元素说法正确的是_______ (填序号)
a.简单离子的半径D>C
b.气态氢化物的稳定性D比C强
c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为_______
(5)比较Y元素与其同族短周期元素的氢化物的熔沸点高低_______ > _______ (填氢化物化学式),理由_______
| 元素代号 | A | B | C | D | X | Y |
| 原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为
(3)关于C、D 两种元素说法正确的是
a.简单离子的半径D>C
b.气态氢化物的稳定性D比C强
c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为
(5)比较Y元素与其同族短周期元素的氢化物的熔沸点高低
您最近一年使用:0次
2021-06-22更新
|
377次组卷
|
2卷引用:四川省成都外国语学校2020-2021学年高一下学期第三次(6月)月考化学试题
6 . (1)某化学反应中,反应物的总能量为 ,生成物的总能量为
,生成物的总能量为 ,且
,且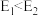 ,则该反应是
,则该反应是___________ (填“放热”或“吸热”)反应。
(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。如果用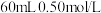 盐酸与
盐酸与 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等、不相等”),所求中和热___________ (填“相等、不相等”)。该装置有明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为___________ 。

(3)如图是元素周期表的一部分,回答下列问题:
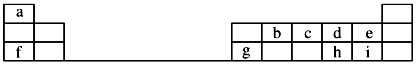
①f、g、h、i对应简单离子的半径由大到小的顺序为___________ (用具体微粒符号表示)。
②b、c、d三种原子的得电子能力由大到小为___________ (用具体微粒符号表示)。
③c、d、e、i分别与氢形成的简单的氢化物中最稳定的物质的化学式是___________
 ,生成物的总能量为
,生成物的总能量为 ,且
,且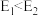 ,则该反应是
,则该反应是(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。如果用
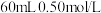 盐酸与
盐酸与 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量
(3)如图是元素周期表的一部分,回答下列问题:

①f、g、h、i对应简单离子的半径由大到小的顺序为
②b、c、d三种原子的得电子能力由大到小为
③c、d、e、i分别与氢形成的简单的氢化物中最稳定的物质的化学式是
您最近一年使用:0次
7 . 表是元素周期表的一部分,针对表中①~⑩元素,用元素符号或化学式 填空:
(1)表中元素,化学性质最不活泼的是_______ ,只有负价而无正价的是_______ ,金属性最强的元素是_______ ,非金属性最强的元素是_______ 。
(2)在③~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是_______ ,碱性最强的是_______ ,呈两性的氢氧化物是_______ ;写出三者之间互相反应的方程式:_______ 、_______ 、_______ 。
(3)③与④,化学性质较活泼的是③,怎样用化学实验证明?答_______ ,在⑦与⑩的单质中,化学性质较活泼的是_______ ,可用化学反应说明该事实:_______ 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是
(2)在③~⑧元素中,元素的最高价氧化物对应的水化物中酸性最强的是
(3)③与④,化学性质较活泼的是③,怎样用化学实验证明?答
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分,用化学用语回答下列问题:
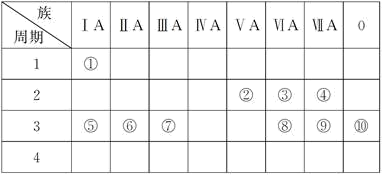
(1)请画出元素⑨阴离子的结构示意图:___________ 。
(2)③⑤⑧的原子半径由小到大的顺序为___________ (填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为___________ >___________ (填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为___________ 。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________ 。

(1)请画出元素⑨阴离子的结构示意图:
(2)③⑤⑧的原子半径由小到大的顺序为
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为
(5)用电子式表示⑥和⑨形成的化合物的过程:
您最近一年使用:0次
2021-06-01更新
|
177次组卷
|
5卷引用:四川省内江市威远中学2019-2020学年高一下学期第二次月考化学试题
名校
9 . (I)下面是我们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是_____ 。
(2) NaHSO4熔融状态下电离,其电离方程式:_____________ 。
(3) NaOH中含有的化学键为离子键和____________ (极性共价键或非极性共价键)。
(Ⅱ)下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④的原子结构示意图是________ 。
(2)在相同条件下,元素②③④的单质分别与盐酸反应,反应最慢的是________ (填化学式),这三种元素最高价氧化物对应水化物有两者能相互反应,其反应离子方程式为__________ 。
(3)元素⑤⑥⑦的气态氢化物中稳定性最弱的是________ (填化学式),沸点最高的是_____ (填化学式),其沸点最高的原因为________ 。
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是
(2) NaHSO4熔融状态下电离,其电离方程式:
(3) NaOH中含有的化学键为离子键和
(Ⅱ)下表列出了①~⑦七种元素在周期表中的位置:
| IA | 0 | |||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 二 | ⑤ | |||||||
| 三 | ② | ③ | ④ | ⑥ | ||||
| 四 | ⑦ | |||||||
请按要求回答下列问题。
(1)元素④的原子结构示意图是
(2)在相同条件下,元素②③④的单质分别与盐酸反应,反应最慢的是
(3)元素⑤⑥⑦的气态氢化物中稳定性最弱的是
您最近一年使用:0次
名校
解题方法
10 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语 回答下列问题;
(1)表中⑩号元素有一种含20个中子的核素,请写出其原子符号_______ 。
(2)④、⑦、⑩的离子半径由大到小的顺序为_______ (用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的固体物质,画出该物质的电子式____ ,该物质含有的化学键类型有_____ 。
(4)元素⑩的一种含氧酸是常用的漂白性物质,这种含氧酸的结构式为____ ,元素⑤和⑩的氢化物中,酸性更强的是_____ 。
(5)上述10种元素中的两种能形成一种四核10电子分子,请用电子式表示其形成过程____ 。
| ① | |||||||
| ② | ③ | ④ | ⑤ | ||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中⑩号元素有一种含20个中子的核素,请写出其原子符号
(2)④、⑦、⑩的离子半径由大到小的顺序为
(3)由表中④、⑥元素可以组成一种淡黄色的固体物质,画出该物质的电子式
(4)元素⑩的一种含氧酸是常用的漂白性物质,这种含氧酸的结构式为
(5)上述10种元素中的两种能形成一种四核10电子分子,请用电子式表示其形成过程
您最近一年使用:0次
2021-05-24更新
|
195次组卷
|
4卷引用:四川省遂宁市第二中学2020-2021学年高一下学期半期考试化学试题
四川省遂宁市第二中学2020-2021学年高一下学期半期考试化学试题(已下线)专题03 化学键【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)江西省南昌市进贤县第一中学2020-2021学年高一下学期期末考试化学试题河南省部分名校2020-2021学年高一下学期期末联考化学试题



