名校
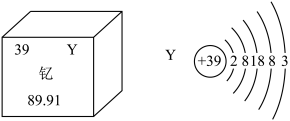
1 . 新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:_______ 个质子,左图中89.91表示的是_______ ;
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据_______ 个电子层;
(3)钇元素形成氧化物的化学式是_______ 。
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据
(3)钇元素形成氧化物的化学式是
您最近一年使用:0次
2022-10-08更新
|
327次组卷
|
3卷引用:新疆和田地区第一中学2022-2023学年高一上学期开学考试化学试题
名校
2 . 根据要求完成。
(1)基态氟原子氟原子有_______ 种不同能量的电子,价电子排布图为_______ 。
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:_______ ; 中有
中有_______ 种运动状态不同的电子。
(3)基态硼原子的核外电子排布图为_______ 。
(4)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(5)锰元素在周期表中的位置为_______ ;属于_______ 区元素(填“s”“p”“d”“ds”或“f”)。铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______ 。
(1)基态氟原子氟原子有
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:
 中有
中有(3)基态硼原子的核外电子排布图为
(4)基态K原子中,核外电子占据最高能层的符号是
(5)锰元素在周期表中的位置为
电离能/ |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
3 . 下表列出了A- H8种元素在周期表中的位置(填元素符号) :
这8种元素分别为A______ ,B________ , C_______ ,D_______ , E_____ ,F___________ , G_______ H______ 。其中化学性质最不活泼的是_____ 。
| 族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | H | |||
| 4 | B |
您最近一年使用:0次
名校
解题方法
4 . 下表为元素周期表中的一部分,列出10种元素在周期表中的位置,用化学符号回答下列各题。
(1)10种元素中,化学性质最不活泼的是___________ 。
(2)以上元素最高价氧化物对应的水化物中,碱性最强的是___________ 。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是___________ 。
(4)元素⑦的氢化物的化学式为___________ 。
(5)①和⑨两元素形成化合物的电子式为___________ :该化合物焰色试验为___________ 色。
(6)⑤的最高价氧化物与氢氧化钠反应的离子方程式为___________ 。
| 主族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)以上元素最高价氧化物对应的水化物中,碱性最强的是
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是
(4)元素⑦的氢化物的化学式为
(5)①和⑨两元素形成化合物的电子式为
(6)⑤的最高价氧化物与氢氧化钠反应的离子方程式为
您最近一年使用:0次
2022-03-08更新
|
170次组卷
|
2卷引用:新疆乌苏市第一中学2021-2022学年高一下学期开学考试化学(A)试题
解题方法
5 . 表中列出了A~R这9种元素在周期表中的位置:
请回答下列问题。
(1)表中部分元素的元素符号分别是:E____ ,H___ 。
(2)R的原子结构示意图为___ 。
(3)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___ 。
(4)A、B、C三种元素按原子半径由大到小的顺序排列为___ 。
(5)F元素与氢元素组成10个电子的分子的化学式为___ ,在常温下该分子可与B发生反应,所得溶液的pH____ 7(填“>”、“<”、“=”)。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
请回答下列问题。
(1)表中部分元素的元素符号分别是:E
(2)R的原子结构示意图为
(3)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(4)A、B、C三种元素按原子半径由大到小的顺序排列为
(5)F元素与氢元素组成10个电子的分子的化学式为
您最近一年使用:0次
名校
6 . 下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_______ 。
(2)地壳中含量最多的金属元素是____ ,写出元素⑥的简单气态氢化物的化学式______ 。
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是______ ,呈两性的氢氧化物是_______ 。
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是______ ,
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是______ 。
(6)元素⑦与元素⑩相比,非金属性较强的是____ ,能证明这一事实的依据是_____ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)地壳中含量最多的金属元素是
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是
(6)元素⑦与元素⑩相比,非金属性较强的是
您最近一年使用:0次
7 . 下表是元素周期表的一部分。请按要求回答下列有关问题:
(1)元素⑨单质形成的晶体的晶体类型是___________ 。
(2)在这些主族元素中,原子半径最大的是___________ 。(填元素符号)
(3)最高价氧化物对应水化物酸性最强物质的化学式是___________ 。
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为___________ 。
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些主族元素中,原子半径最大的是
(3)最高价氧化物对应水化物酸性最强物质的化学式是
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为
您最近一年使用:0次
2021-07-17更新
|
442次组卷
|
3卷引用:新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高一上学期11月期中考试化学试题
新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高一上学期11月期中考试化学试题江苏省常州市武进区横山桥高级中学2020-2021学年高一下学期期中考试化学试题(已下线)第四章 物质结构 元素周期律(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
解题方法
8 . 某元素X的激发态原子的电子排布式为1s22s22p63s13p3,则该元素基态原子的电子排布式为_______ ,其最高价氧化物属于_______ 晶体;Z原子的核电荷数为33,其在元素周期表中的位置是_______ ,属于_______ 区的元素。
您最近一年使用:0次
解题方法
9 . 如表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素③的原子结构示意图是___________ ,以上元素的最高价氧化物形成的水化物酸性最强的是___________ (填分子式)。
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为___________ (用离子符号表示);②、③两种元素的最高价氧化物对应的水化物碱性由弱到强的顺序是___________ (用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___________ 。
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式___________ 。
(5)设计一个实验比较②与③的金属性强弱___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 二 | ① | ⑦ | ||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为
(4)②和⑦按原子个数比1∶1形成离子化合物的电子式
(5)设计一个实验比较②与③的金属性强弱
您最近一年使用:0次
10 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是________ (填标号)。
A.[Ne] B.[Ne]
B.[Ne] C.[Ne]
C.[Ne] D.[Ne]
D.[Ne]
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________ 。
(3)Cu2+基态核外电子排布式为__________________ 。
(4)Mn位于元素周期表中第四周期________ 族,基态Mn原子核外未成对电子有________ 个。
(5)丙酮( )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是_____ 、______ 。
(6)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________ ,提供孤电子对的成键原子是___________ 。
A.[Ne]
 B.[Ne]
B.[Ne] C.[Ne]
C.[Ne] D.[Ne]
D.[Ne]
(2)Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为
(3)Cu2+基态核外电子排布式为
(4)Mn位于元素周期表中第四周期
(5)丙酮(
 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(6)在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
您最近一年使用:0次



