2022·山东聊城·一模
1 . 石墨烯、高温氯化钠、砷化镉等超导材料应用广泛。回答下列问题:
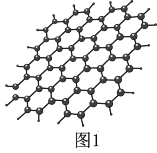
(1)石墨烯结构如图1所示,则碳原子的杂化方式为_______ ,12 g石墨烯中含有六元环个数与σ键个数之比为_______ 。
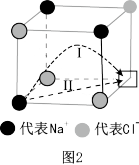
(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径_______ (填图中序号)迁移到空位处。
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由_______ 。
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为_______ ;与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,原因是_______ 。
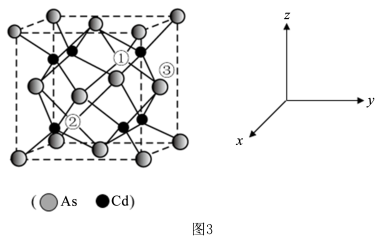
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3, 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞的密度为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为_______ pm(列计算式即可)。
(1)石墨烯结构如图1所示,则碳原子的杂化方式为

(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3,
 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
您最近一年使用:0次
2022-03-29更新
|
699次组卷
|
4卷引用:必刷卷05-2022年高考化学考前信息必刷卷(河北专用)
(已下线)必刷卷05-2022年高考化学考前信息必刷卷(河北专用)河北省石家庄市第二中学2022届高三2.5模化学试题山东省聊城市2021-2022学年下学期高三一模化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(山东专用)
名校
解题方法
2 . 砷化镓(GaAs)是一种立方晶系的晶体,其晶胞结构如图甲所示。将Mn掺杂到晶体中得到稀磁性半导体材料,其晶胞结构如图乙所示。砷化镓的晶胞参数为xpm。下列说法错误的是
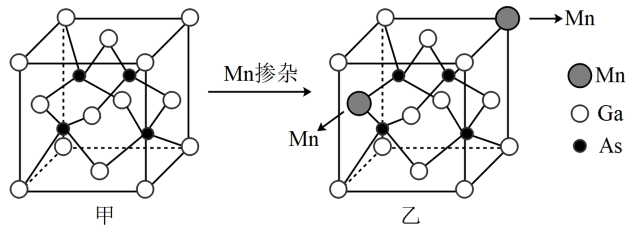

| A.1molGaAs中配位键的数目是NA |
B.GaAs晶体中,Ga和As的最近距离是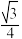 xpm xpm |
| C.元素的电负性:Ga<As |
| D.稀磁性半导体材料中,Mn、As的原子个数比为1:2 |
您最近一年使用:0次
2023-05-15更新
|
599次组卷
|
2卷引用:河北省部分示范性高中2023届高三三模化学试题
解题方法
3 . 食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱 和小苏打
和小苏打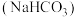 。下列说法正确的是
。下列说法正确的是
 和小苏打
和小苏打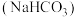 。下列说法正确的是
。下列说法正确的是A.离子半径: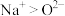 | B.电负性: |
C.非金属性: | D.第一电离能: |
您最近一年使用:0次
2023-12-01更新
|
550次组卷
|
5卷引用:河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题
名校
解题方法
4 . 由徐光宪院士发起院士学子同创的《分子共和国》科普读物生动形象地戏说了BF3、NH3、H2S、O3、CH3COOH、SOCl2等众多“分子共和国”中的明星。下列说法正确的是
| A.键角:NH3<BF3 |
| B.酸性:CH3COOH>CF3COOH |
| C.SOCl2分子中只存在σ键,不存在π键 |
| D.H2S、O3分子的空间结构均为直线形,且均为非极性分子 |
您最近一年使用:0次
2022-10-27更新
|
1202次组卷
|
14卷引用:河北省石家庄市第九中学2022-2023高三上学期10月月考化学试题
河北省石家庄市第九中学2022-2023高三上学期10月月考化学试题广东省云浮市2021-2022学年高二下学期期末教学质量检测化学试题湖北省恩施州高中教育联盟2021-2022学年高二下学期期末考试化学试题广东省梅州市梅江区梅州中学2022-2023学年高三上学期8月阶段性考试化学试题宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第二次月考化学试题(已下线)第37讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题七 非金属元素及其化合物-实战高考·二轮复习核心突破广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题 广东省广州市第六中学2022-2023学年高二下学期期末考试化学试题(已下线)第05讲 分子结构与物质的性质-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)热点05 分子结构与物质的性质四川省达州市万源中学2023-2024学年高二下学期4月月考化学试题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
5 . 由原子序数依次增大的短周期主族元素X、Y、Z、R组成的一种化合物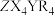 ,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
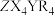 ,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是
,常用作阻燃剂,农用杀虫、杀菌剂。其结构如图,已知该化合物阴、阳离子的空间结构都是正四面体形;Y、Z、R位于同周期且Y和R的原子序数之和等于Z的2倍。下列叙述错误的是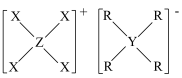
A.电负性: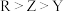 | B.键角: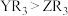 |
C.最简单氢化物的稳定性: | D.1 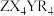 含1 含1 配位键 配位键 |
您最近一年使用:0次
2024-03-30更新
|
555次组卷
|
5卷引用:河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题
名校
解题方法
6 . X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数目之和为M价电子数的两倍;化合物 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是
 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是| A.原子半径:Z<X<Y<M | B.简单氢化物的稳定性:X>Y>M |
| C.Z与M形成的化合物具有较强的还原性 | D.Y的含氧酸为弱酸 |
您最近一年使用:0次
2023-04-10更新
|
741次组卷
|
5卷引用:河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题
河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题(已下线)专题06 物质结构与性质江西省吉安市吉州区部分学校联考2022-2023学年高二下学期期末考试化学试题(已下线)2019年高考江苏卷化学试题变式题(单选题6-10)江苏省江阴市华士高级中学2023-2024学年高二上学期10月学情调研化学(选修)试题
2023·江苏·一模
7 . 工业上用C还原SiO2可得半导体材料Si和CO。下列说法正确的是
| A.键能大小:E(C-C)<E(Si-Si) |
| B.电离能大小:I1(Si)< I1(O) |
| C.电负性大小:x(O)< x(C) |
| D.酸性强弱:H2CO3<H2SiO3 |
您最近一年使用:0次
解题方法
8 . 氢气和二氧化碳在催化剂作用下,在180-280℃温度下合成甲醇,该反应放热。催化过程可解释为“吸附-活化-解离”,催化反应机理如图所示。下列说法正确的是
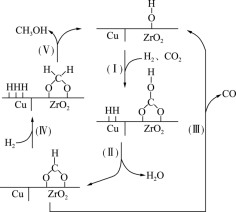
| A.反应过程中I-V步,C化合价不变 |
| B.单位时间内,生成水越多,甲醇产率越大 |
| C.增大催化剂的表面积,可以提高甲醇的平衡产率 |
| D.因为电负性O>C,所以CO2中的C与吸附在氧化锆晶格表面的OH上的O原子结合 |
您最近一年使用:0次
2023-05-18更新
|
551次组卷
|
2卷引用:河北省邯郸市2023届高考第三次模拟(保温卷)化学试题
名校
解题方法
9 . 磷酸铁锂(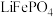 )电极材料主要用于各种锂离子电池。回答下列问题
)电极材料主要用于各种锂离子电池。回答下列问题
(1)Fe位于元素周期表中第___________ 周期第___________ 族,其外围电子排布式为___________ 。
(2)离子半径: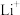
___________  ;第一电离能:Li
;第一电离能:Li___________ Be;电负性:O___________ P。(填“>”“<”或“=”)
(3)下列Li的轨道表示式表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.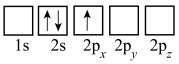
C.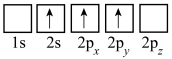 D.
D.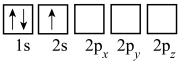
(4)基态P中未成对的电子数为___________ ,其原子核外电子占据的最高能级的电子云轮廓为___________ 形。
(5)Mn与Fe两元素的部分电离能数据如下,由表中两元素的 和
和 可知,气态
可知,气态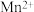 再失去一个电子比气态
再失去一个电子比气态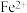 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是___________ 。
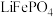 )电极材料主要用于各种锂离子电池。回答下列问题
)电极材料主要用于各种锂离子电池。回答下列问题(1)Fe位于元素周期表中第
(2)离子半径:
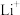
 ;第一电离能:Li
;第一电离能:Li(3)下列Li的轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(4)基态P中未成对的电子数为
(5)Mn与Fe两元素的部分电离能数据如下,由表中两元素的
 和
和 可知,气态
可知,气态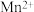 再失去一个电子比气态
再失去一个电子比气态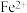 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是| 元素 | Mn | Fe | |
| 电离能(kJ/mol) |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 |
您最近一年使用:0次
2024-02-11更新
|
510次组卷
|
2卷引用:河北省邯郸市永年区第二中学2023-2024学年高二上学期12月月考化学试题
名校
10 . 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是
| A.N元素基态原子所有价电子的电子云轮廓图均为哑铃形 |
| B.Se元素基态原子的电子排布式为[Ar]4s24p4 |
| C.O、F、Cl电负性由大到小的顺序为F>Cl>O |
| D.第一电离能As>Se |
您最近一年使用:0次
2023-03-24更新
|
542次组卷
|
4卷引用:河北省2023届高三下学期高考前适应性考试化学试题



