名校
解题方法
1 . 以下是某探究活动中,使用了多种研究物质性质的方法,其中没有涉及的是
| 课题 | 金属钠与氧气反应的实验 |
| 实验目的 | (1)探究金属钠与氧气的反应 (2)认识条件控制在实验研究中的意义 |
| 仪器与试剂 | 金属钠、酒精灯、石棉网、铁架台、铁圈等 |
| 实验步骤 | (1)将切好的金属钠放置在空气中,使其与氧气反应 (2)将金属钠放在石棉网上加热,使其与氧气反应 |
| 实验记录 | 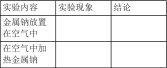 |
| A.实验法 | B.观察法 | C.分类法 | D.比较法 |
您最近一年使用:0次
2021-10-10更新
|
115次组卷
|
6卷引用:福建省南平市政和县第一中学2023-2024学年高一上学期第一次月考化学试题
2 . 超酸是一类比纯硫酸更强的酸,在石油重整中用作高效催化剂。某实验小组对超酸HSbF6的制备及性质进行了探究。由三氯化锑(SbCl3)制备HSbF6的反应如下: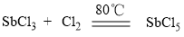 、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的初始实验装置如图(毛细管连通大气,减压时可吸入极少量空气,防止液体暴沸;夹持、加热及搅拌装置略):
、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的初始实验装置如图(毛细管连通大气,减压时可吸入极少量空气,防止液体暴沸;夹持、加热及搅拌装置略):
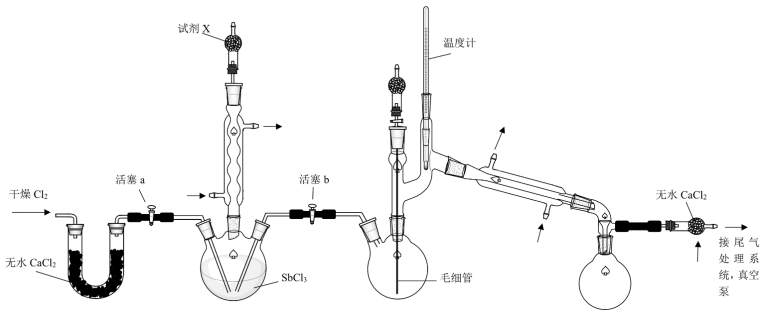
相关性质如表:
回答下列问题:
(1)实验装置中两个冷凝管___ (填“能”或“不能”)交换使用。
(2)试剂X的作用为___ 、___ 。
(3)反应完成后,关闭活塞a、打开活塞b,减压转移___ (填仪器名称)中生成的SbCl5至双口烧瓶中。用真空泵抽气减压蒸馏前,必须关闭的活塞是___ (填“a”或“b”);用减压蒸馏而不用常压蒸馏的主要原因是___ 。
(4)实验小组在由SbCl5制备HSbF6时,没有选择玻璃仪器,其原因为___ 。(写化学反应方程式)
(5)为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为___ 。
(6)实验小组在探究实验中发现蜡烛可以溶解于HSbF6中,同时放出氢气。已知烷烃分子中碳氢键的活性大小顺序为:甲基(—CH3)<亚甲基(—CH2—)<次甲基( )。写出2—甲基丙烷与HSbF6反应的离子方程式
)。写出2—甲基丙烷与HSbF6反应的离子方程式___ 。
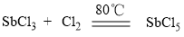 、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的初始实验装置如图(毛细管连通大气,减压时可吸入极少量空气,防止液体暴沸;夹持、加热及搅拌装置略):
、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的初始实验装置如图(毛细管连通大气,减压时可吸入极少量空气,防止液体暴沸;夹持、加热及搅拌装置略):
相关性质如表:
| 物质 | 熔点 | 沸点 | 性质 |
| SbCl3 | 73.4℃ | 220.3℃ | 极易水解 |
| SbCl5 | 3.5℃ | 140℃分解79℃/2.9kPa | 极易水解 |
(1)实验装置中两个冷凝管
(2)试剂X的作用为
(3)反应完成后,关闭活塞a、打开活塞b,减压转移
(4)实验小组在由SbCl5制备HSbF6时,没有选择玻璃仪器,其原因为
(5)为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为
(6)实验小组在探究实验中发现蜡烛可以溶解于HSbF6中,同时放出氢气。已知烷烃分子中碳氢键的活性大小顺序为:甲基(—CH3)<亚甲基(—CH2—)<次甲基(
 )。写出2—甲基丙烷与HSbF6反应的离子方程式
)。写出2—甲基丙烷与HSbF6反应的离子方程式
您最近一年使用:0次
2021-10-09更新
|
8511次组卷
|
15卷引用:福建省龙岩市连城县第一中学2023-2024学年高三上学期8月月考化学试题
福建省龙岩市连城县第一中学2023-2024学年高三上学期8月月考化学试题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型179 气液、液液反应型制备实验(已下线)题型45 物质性质探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2021年新高考湖北化学高考真题2021年湖北高考化学试题变式题11-19(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)2022年浙江省6月高考真题变式题26-31(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编(已下线)易错点31 化学实验常用仪器-备战2023年高考化学考试易错题
名校
解题方法
3 . 氨化钙(Ca3N2)是高端荧光粉的主要成分之一,其极易与水剧烈反应生成氨气。利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨不溶于煤油)。下列说法中正确的是
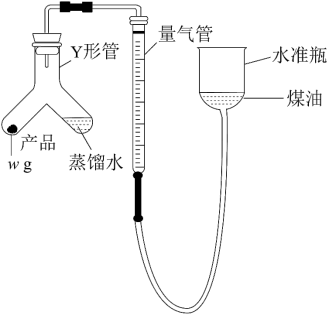
| A.往下移动水准瓶,量气管与水准瓶内液面不发生变化,说明气密性良好 |
| B.还可以利用该装置测定CaC2样品(假定杂质不与水反应)的纯度 |
| C.Y形管内残留有反应产生的气体,造成结果偏低 |
| D.反应结束,冷却至室温后,未调整水准瓶的高度即读数,会造成结果偏低 |
您最近一年使用:0次
2021-04-09更新
|
1632次组卷
|
4卷引用:福建省福州第四中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
4 . 某研究小组同学用如图装置探究SO2与Mg的反应,实验时首先关闭K,使①中的反应进行,然后加热玻璃管。下列说法正确的是
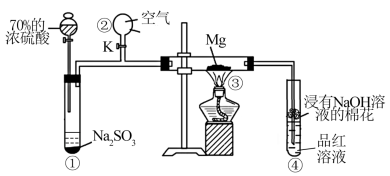

| A.③中发生的反应为复分解反应 |
| B.停止实验时,打开K可防倒吸 |
| C.实验结束后加热④中溶液,没有明显现象 |
| D.浸有NaOH溶液的棉花是用来吸收空气中的CO2的 |
您最近一年使用:0次
2020-09-15更新
|
1093次组卷
|
7卷引用:福建省莆田第十五中学2022-2023学年高一下学期第一次月考(3月)化学试题
福建省莆田第十五中学2022-2023学年高一下学期第一次月考(3月)化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题鲁科版(2019)高一必修第一册第三章B 素养拓展区 过综合 章末素养综合检测高一必修第一册(苏教2019版)专题4 B 素养拓展区 过素养 学科素养拓展训练山东省胶州市实验中学2020-2021学年高一上学期12月月考化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性
名校
5 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
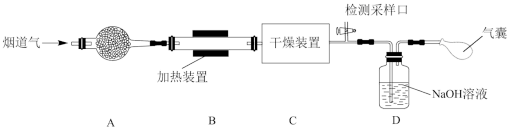
(1)装置A中放置无碱玻璃棉,其目的是除去___________ 。为保证检测的准确性,装置C中盛放的化学试剂可以是___________ (填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为_______ (填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3-,发生反应的离子方程式是___________ 。
(3)溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2,实现氮元素的脱除,具体步骤如下:
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。
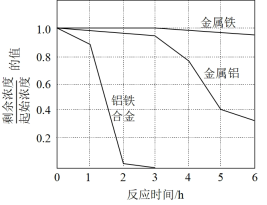
①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是___________ 。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因________ 。
(4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl-,发生反应的离子方程式是___________ 。

(1)装置A中放置无碱玻璃棉,其目的是除去
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3-,发生反应的离子方程式是
(3)溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2,实现氮元素的脱除,具体步骤如下:
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因
(4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl-,发生反应的离子方程式是
您最近一年使用:0次
2020-07-03更新
|
207次组卷
|
2卷引用:福建省福州格致中学2022-2023学年高一下学期期末考试化学试题
6 . I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。
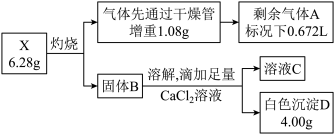
请回答:
(1)X中含有的非金属元素是_______ ,写出X灼烧的化学方程式是_______ 。
(2)向X的溶液中通入少量SO2,请写出离子方程式_______ 。
II.某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(3)该兴趣小组所记录的实验现象说明铜与铁离子的反应_______ (填有或没有)限度。
(4)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:_______ 、_______ 。
(5)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):_______ 。

请回答:
(1)X中含有的非金属元素是
(2)向X的溶液中通入少量SO2,请写出离子方程式
II.某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(3)该兴趣小组所记录的实验现象说明铜与铁离子的反应
(4)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:
(5)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
您最近一年使用:0次
2020-06-24更新
|
317次组卷
|
2卷引用:福建省龙岩市长汀县2023届高三下学期5月质量检测化学试题
7 . 探究金属与过量浓硫酸反应的装置(固定装置已略去)如下图所示。关于实验操作或叙述错误的是
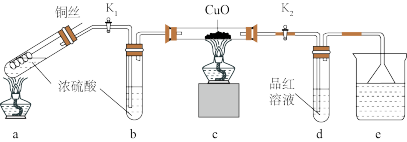

| A.上下抽动铜丝,可控制反应随时发生或停止 |
| B.e中可以选用NaOH溶液或酸性KMnO4溶液 |
| C.其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同 |
| D.为确定a中白色固体是否是硫酸铜,可向冷却后的试管中注入水,振荡后观察现象 |
您最近一年使用:0次
2020-06-20更新
|
1931次组卷
|
11卷引用:福建省厦门市翔安第一中学2023-2024学年高三上学期10月月考化学试题
福建省厦门市翔安第一中学2023-2024学年高三上学期10月月考化学试题上海市吴淞中学2023-2024学年高一上学期期末质量检测 化学试题广东省揭阳市惠来同仁北实高级中学2023-2024学年高三上学期期中考试化学试题湖北省武汉市2020届高三毕业生六月供题(二)理科综合化学试题湖南省衡阳市第一中学2021届高三上学期第二次月考化学试题(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)山东省济宁市邹城二中2020-2021学年高一下学期6月月考化学试题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题山西师范大学实验中学2021-2022学年高一下学期第二次月考化学试题广东省梅州兴宁市沐彬中学2021-2022学年高一下学期 3月月考化学试题
8 . 84消毒液的主要成份是NaCl和NaClO。实验小组同学围绕“84消毒液能否与医用酒精发生反应”这一问题进行了如下实验。
下列推理不合理的是
| 序号 | 实验 | 现象 |
| ① | 分别取40 mL84消毒液和医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
| ② | 分别取40 mL医用酒精和蒸馏水混合均匀,水浴至23℃ | 溶液中无明显现象 |
| ③ | 分别取40 mL84消毒液和蒸馏水混合均匀,水浴至23℃ | 溶液中无明显现象,略有刺激性气味 |
| ④ | 分别取40 mL84消毒液、40 mL医用酒精和少量白醋,混合均匀 | 产生大量气泡,有强烈地刺激性气味,溶液逐渐变为淡黄色 |
下列推理不合理的是
| A.由①②可知,①中产生的大量气泡与酒精挥发无关 |
| B.由①③可知,①中刺激性气味的产生可能与酒精无关 |
| C.由①②③可推断,84消毒液与医用酒精混合后,溶液中发生了化学反应 |
| D.由①④可推断,酸性条件有利于84消毒液与医用酒精发生反应 |
您最近一年使用:0次
2020-06-07更新
|
917次组卷
|
13卷引用:福建省厦门第二中学2023-2024学年高一上学期第一次月考化学试题
福建省厦门第二中学2023-2024学年高一上学期第一次月考化学试题福建省宁德第一中学2023-2024学年高一上学期10月月考化学试题福建省厦门市双十中学2022-2023学年高一上学期10月月考化学试题北京师范大学附属中学2023-2024学年高一上学期期中考试化学试题广东省广州市真光中学2023-2024学年高一上学期12月阶段性测试化学试题北京市海淀区2020届高三二模化学试题(已下线)【浙江新东方】87.江苏省徐州一中、兴化中学2021届高三上学期第二次适应性考试化学试题河南省新蔡县2021届高三上学期期末调研考试化学试题(已下线)第31讲 乙醇和乙酸(精练)-2022年高考化学一轮复习讲练测(已下线)北京市第四中学2021-2022学年高一上学期期中考试化学试题山西省晋城市第一中学2022-2023学年高一上学期第三次调研考试化学试题北京市第二十中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
9 . 某研究性学习小组为了证明铁的金属性比铜强,他们设计了如下几种方案,合理的是( )
| A.铁、铜与氯气反应分别生成 FeCl3、CuCl2 |
| B.足量的铁粉和铜粉与浓硫酸在加热的条件下反应分别生成 FeSO4 和 CuSO4 |
| C.将铜片置于 FeCl3 溶液中铜片逐渐溶解 |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上有气泡产生 |
您最近一年使用:0次
2020-03-20更新
|
164次组卷
|
2卷引用:福建省福州第一中学2022-2023学年高三上学期第一次调研测试化学试题
名校
10 . 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)CoC2O4·2H2O中C的化合价是____________________________ 。
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________ 。
(3)浸出液中加入NaClO3的目的是____________________________ 。
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是______________ (填化学式),试用离子方程式和必要的文字简述其原理:____________________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______________ ;其使用的适宜pH范围是______________ 。

A. 2.0〜2.5
B. 3.0〜3.5
C. 4.0〜4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+) =______________ 。
(7)用m1kg水钴矿(含Co2O360%)制备CoC2O4·2H2O,最终得到产品m2kg,产率(实际产量/理论产量×100%)为____________________________ 。(已知:M(Co2O3)=166,M(CoC2O4·2H2O)=183,仅需列出数字计算式)。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)CoC2O4·2H2O中C的化合价是
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:
(3)浸出液中加入NaClO3的目的是
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是

A. 2.0〜2.5
B. 3.0〜3.5
C. 4.0〜4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+) =
(7)用m1kg水钴矿(含Co2O360%)制备CoC2O4·2H2O,最终得到产品m2kg,产率(实际产量/理论产量×100%)为
您最近一年使用:0次
2019-07-04更新
|
229次组卷
|
2卷引用:福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高三上学期12月月考化学试题



