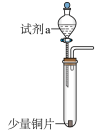
名校
解题方法
1 . 二氧化硫和亚硫酸在工农业生产中具有重要的用途。某化学兴趣小组对 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:
Ⅰ.某同学设计了如图装置用于制取 和验证
和验证 的性质。
的性质。 具有一定氧化性。
具有一定氧化性。
(1)装置A中发生反应的化学方程式为___________ 。
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→___________ (填装置字母,还原性设计两个装置)。
(3)实验前必须鼓入 ,目的是
,目的是___________ 。
(4)装置F中产生了白色沉淀,其成分是___________ (化学式)。
(5)实验中发现装置A中 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
Ⅱ.探究 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。___________ (填装置标号)。
(7)能证明 的酸性强于
的酸性强于 的现象
的现象___________ 。
 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:Ⅰ.某同学设计了如图装置用于制取
 和验证
和验证 的性质。
的性质。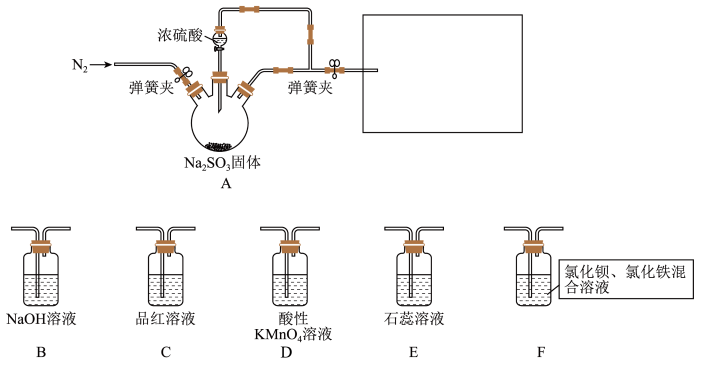
 具有一定氧化性。
具有一定氧化性。(1)装置A中发生反应的化学方程式为
(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→(3)实验前必须鼓入
 ,目的是
,目的是(4)装置F中产生了白色沉淀,其成分是
(5)实验中发现装置A中
 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为Ⅱ.探究
 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。
(7)能证明
 的酸性强于
的酸性强于 的现象
的现象
您最近一年使用:0次
名校
解题方法
2 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
3 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。回答下列问题:
Ⅰ.如图是硫元素的“价—类”二维图。______ ; 属于
属于______ (填“酸性氧化物”或“碱性氧化物”)。
(2) 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
(3) 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是______ 。
Ⅱ.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证 的部分性质。
的部分性质。______ 。
(5)装置A中发生反应的化学方程式为______ ,该反应中氧化剂与还原剂的物质的量之比为______ 。
(6)装置B中湿润的品红溶液褪色,证明 有
有______ (填“漂白性”或“氧化性”);装置C中产生白色沉淀,该白色沉淀为______ (填化学式)。
Ⅰ.如图是硫元素的“价—类”二维图。
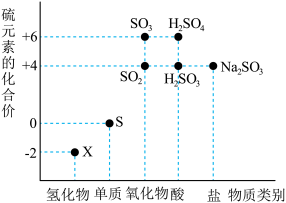
 属于
属于(2)
 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。| A.把工厂烟囱造高 | B.煤使用之前先脱硫 |
| C.逐渐用新能源代替含硫煤 | D.加强空气中二氧化硫的监测 |
(3)
 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是Ⅱ.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证
 的部分性质。
的部分性质。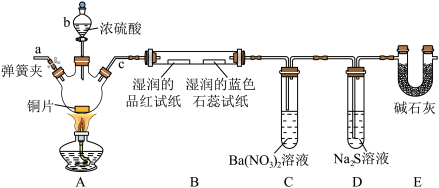
(5)装置A中发生反应的化学方程式为
(6)装置B中湿润的品红溶液褪色,证明
 有
有
您最近一年使用:0次
解题方法
4 . 过氧化氢是淡蓝色的黏稠液体,可。与水以任意比例混溶,是一种强氧化剂。其一般以30%~60%的水溶液形式存放,水溶液俗称双氧水,适用于医用伤口消毒,环境消毒和食品消毒等。回答下列问题:
(1)实验室中利用反应2H2O2 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是___________ (填字母,下同),收集O2可选用的装置是___________ (填字母)。___________ mL(保留三位有效数字)。
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:___________
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
⑤数据分析、交流讨论。
实验结果:X2<X1<X3且X1=___________ ,测得pH数据中能证明上述猜想的是___________ (用X1、X2、X3的大小关系表示);pH出现X1<X3的原因是___________ 。
⑥优化实验。在20℃下进行下列实验:
若实验中测得△T1___________ △T2(填“>”或“<”),则说明H2O2电离过程吸热。
(1)实验室中利用反应2H2O2
 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是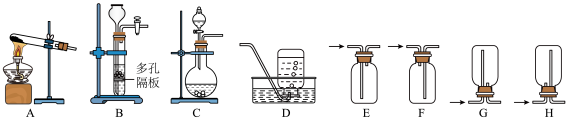
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
| 试祥 | 温度/℃ | pH | |
| 1 | 10mL1.5mol/L的双氧水 | 20 | X1 |
| 2 | 10mL1.5mol/L的双氧水 | 30 | X2 |
| 3 | 10mL1.5mol/L的双氧水 | 50 | X3 |
实验结果:X2<X1<X3且X1=
⑥优化实验。在20℃下进行下列实验:
| 试样 | 反应前后温度变化/℃ | |
| 4 | 10mL1.5mol/L的双氧水、10mL1.5mol/L的NaOH溶液 | △T1 |
| 5 | 10mL1.5mol/L的H2SO4溶液10mL1.5mol/L的NaOH溶液 | △T2 |
您最近一年使用:0次
解题方法
5 . Ⅰ.铸铁的主要成分为Fe和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。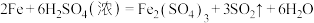 、
、________ 。
(2)实验现象:①________ ,证明确实有SO2生成。
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明________ 。
(3)检测反应后A中所得溶液中含有 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加________ ,现象为________ 证明有 。
。
(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为________ 。
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将 还原为
还原为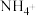 的转化关系如下:
的转化关系如下:

(5)纳米Fe制备原理: ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是________ 。
(6)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是________ 。
(7)检验溶液中 的操作和现象是
的操作和现象是________ 。
(8)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是________ (答1条)。
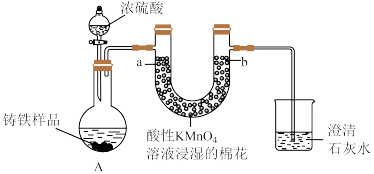
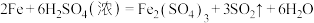 、
、(2)实验现象:①
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明
(3)检测反应后A中所得溶液中含有
 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加 。
。(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将
 还原为
还原为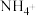 的转化关系如下:
的转化关系如下:
(5)纳米Fe制备原理:
 ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是(6)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(7)检验溶液中
 的操作和现象是
的操作和现象是(8)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是
您最近一年使用:0次
名校
解题方法
6 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被
可被 还原为
还原为 。
。
iii. 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
(1)B中试剂是___________ 。
(2)通入 前,II、III中沉淀由白色
前,II、III中沉淀由白色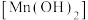 变为棕黑色,补全发生反应的化学方程式:
变为棕黑色,补全发生反应的化学方程式:___________ 。

(3)对比实验I、II通入 后的实验现象,对于二价锰化合物还原性的认识是:
后的实验现象,对于二价锰化合物还原性的认识是:
①___________ ;
②在碱性条件下二价锰可以被氧化到更高价态。
(4)根据资料ii,II中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
IV中溶液紫色迅速变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是 被
被___________ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③分析IV、V实验现象不同的原因是___________ 。
资料:i.
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被
可被 还原为
还原为 。
。iii.
 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)

| 序号 | I | II | III |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
通入 前C中实验现象 前C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
通入 后C中实验现象 后C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)B中试剂是
(2)通入
 前,II、III中沉淀由白色
前,II、III中沉淀由白色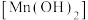 变为棕黑色,补全发生反应的化学方程式:
变为棕黑色,补全发生反应的化学方程式:
(3)对比实验I、II通入
 后的实验现象,对于二价锰化合物还原性的认识是:
后的实验现象,对于二价锰化合物还原性的认识是:①
②在碱性条件下二价锰可以被氧化到更高价态。
(4)根据资料ii,II中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | IV | V |
| 操作 | 取III中放置后的1mL悬浊液,加入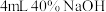 溶液 溶液 | 取III中放置后的1mL悬浊液,加入4mL水 |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 被
被③分析IV、V实验现象不同的原因是
您最近一年使用:0次
名校
7 . 某化学兴趣小组同学利用如图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
(1)仪器a的名称_________ 。
(2)装置D和F的作用是_________ 。
(3)加热时,装置A中反应的化学方程式__________ 。
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是___________ ,若要证明其过程是可逆的,还需要的操作是______________ 。

(1)仪器a的名称
(2)装置D和F的作用是
(3)加热时,装置A中反应的化学方程式
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是
您最近一年使用:0次
8 . 某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为________________ 。
(2)乙同学认为还可能产生氢气的理由是________________ 。
(3)A中加入的试剂可能是________ ,作用是________ ;B中加入的试剂可能是________ ,作用是________ ;E中加入的试剂可能是________ ,作用是________ 。
(4)可以证明气体X中含有氢气的实验现象:C中________ ,D中________ 。
(5)装有酸性高锰酸钾试剂瓶中的现象是________________ ,涉及到的离子反应反应方程式为________________ 。

试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为
(2)乙同学认为还可能产生氢气的理由是
(3)A中加入的试剂可能是
(4)可以证明气体X中含有氢气的实验现象:C中
(5)装有酸性高锰酸钾试剂瓶中的现象是
您最近一年使用:0次
名校
解题方法
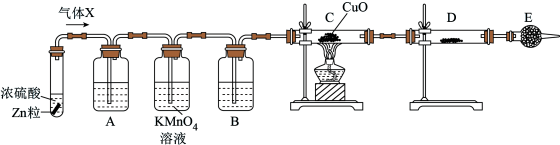
9 . 某化学活动小组利用如下装置制备氯气并进行相关的性质验证。
已知:
① 易溶于有机溶剂四氯化碳(
易溶于有机溶剂四氯化碳( ),且所得溶液呈橙红色;
),且所得溶液呈橙红色;
② 不溶于水,密度比水大。
不溶于水,密度比水大。
(1)装置A中发生反应的化学方程式为
(2)m的作用是
(3)装置C中的现象是
(4)装置D中发生反应的离子方程式为
(5)取少量反应后的B中溶液,向其中加入
 ,振荡后静置,若出现
,振荡后静置,若出现 被氧化。
被氧化。(6)另取少量反应后的B中溶液于试管中,向其中加入少量
 被氧化。
被氧化。(7)已知氧化性
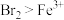 ,向200mL 0.1mol/L
,向200mL 0.1mol/L  溶液中通入标准状况下0.56L
溶液中通入标准状况下0.56L  时反应的离子方程式为
时反应的离子方程式为
您最近一年使用:0次
10 . 某实验小组制备 并探究其性质,实验装置图及实验记录如下。
并探究其性质,实验装置图及实验记录如下。
下列说法正确的是

 并探究其性质,实验装置图及实验记录如下。
并探究其性质,实验装置图及实验记录如下。序号 | 操作 | 现象 |
① | 取 烧杯中的溶液于试管中,加 烧杯中的溶液于试管中,加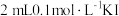 溶液,滴加几滴淀粉溶液 溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 取 烧杯中的溶液于试管中,滴加几滴 烧杯中的溶液于试管中,滴加几滴 至 至 ,加 ,加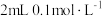  溶液,滴加几滴淀粉溶液 溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 取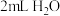 于试管中,滴加几滴 于试管中,滴加几滴 至 至 ,加 ,加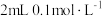  溶液,滴加几滴淀粉溶液, 溶液,滴加几滴淀粉溶液, | 不变蓝 |

A.X为 | B.实验①现象可说明 未参与反应 未参与反应 |
C.实验③主要为了排除 和 和 的干扰 的干扰 | D.上述实验不能证明烧杯中溶液含有 |
您最近一年使用:0次