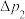解题方法
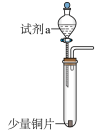
1 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取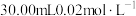 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: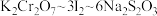 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: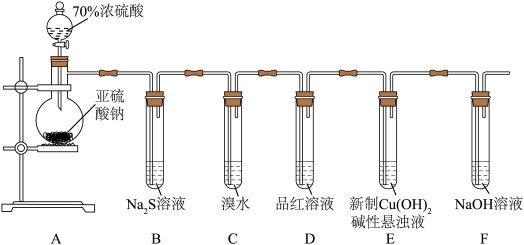
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取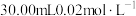 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
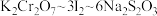 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
名校
解题方法
2 . 二氧化硫和亚硫酸在工农业生产中具有重要的用途。某化学兴趣小组对 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:
Ⅰ.某同学设计了如图装置用于制取 和验证
和验证 的性质。
的性质。 具有一定氧化性。
具有一定氧化性。
(1)装置A中发生反应的化学方程式为___________ 。
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→___________ (填装置字母,还原性设计两个装置)。
(3)实验前必须鼓入 ,目的是
,目的是___________ 。
(4)装置F中产生了白色沉淀,其成分是___________ (化学式)。
(5)实验中发现装置A中 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
Ⅱ.探究 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。___________ (填装置标号)。
(7)能证明 的酸性强于
的酸性强于 的现象
的现象___________ 。
 和
和 的一些性质进行了探究。回答下列问题:
的一些性质进行了探究。回答下列问题:Ⅰ.某同学设计了如图装置用于制取
 和验证
和验证 的性质。
的性质。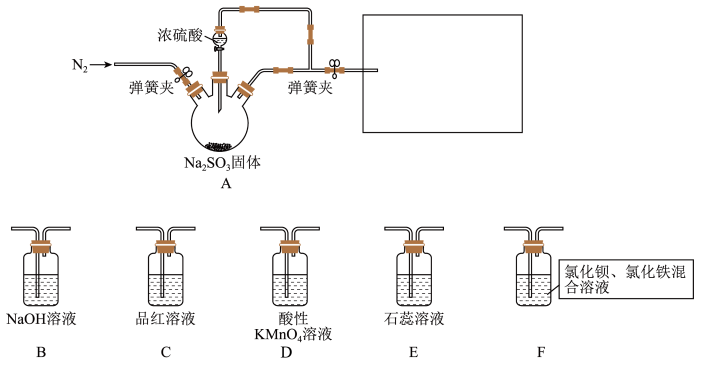
 具有一定氧化性。
具有一定氧化性。(1)装置A中发生反应的化学方程式为
(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→
的漂白性、酸性、还原性,上图各装置按气流从左到右方向连接顺序为A→(3)实验前必须鼓入
 ,目的是
,目的是(4)装置F中产生了白色沉淀,其成分是
(5)实验中发现装置A中
 可能部分被氧化,现需测定
可能部分被氧化,现需测定 的纯度:称取
的纯度:称取 样品,配成
样品,配成 溶液;取其中的
溶液;取其中的 溶液,与
溶液,与 酸性
酸性 溶液发生以下反应:
溶液发生以下反应: ,实验消耗
,实验消耗 溶液
溶液 ,以上样品中
,以上样品中 的质量分数为
的质量分数为Ⅱ.探究
 的酸性强于
的酸性强于 (可能所需要的装置和试剂如图所示)。
(可能所需要的装置和试剂如图所示)。
(7)能证明
 的酸性强于
的酸性强于 的现象
的现象
您最近一年使用:0次
名校
解题方法
3 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
4 . 某学习小组欲利用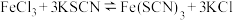 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将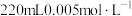
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变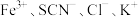 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2mL溶液X,加入5滴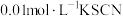 溶液,溶液红色
溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同):取2mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。
(2)取2mL溶液X,加入5滴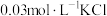 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。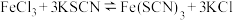 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ ,二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应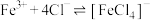 。
。
(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②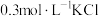 溶液、溶液、③
溶液、溶液、③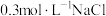 溶液、④
溶液、④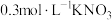 溶液、⑤
溶液、⑤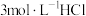 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。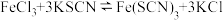 平衡体系的实验组是
平衡体系的实验组是____ ,盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
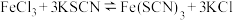 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将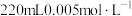
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
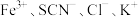 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2mL溶液X,加入5滴
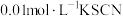 溶液,溶液红色
溶液,溶液红色(2)取2mL溶液X,加入5滴
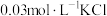 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
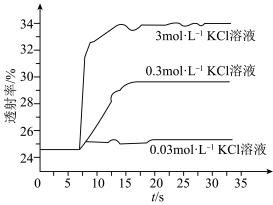
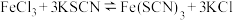 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应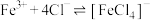 。
。(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②
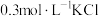 溶液、溶液、③
溶液、溶液、③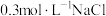 溶液、④
溶液、④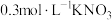 溶液、⑤
溶液、⑤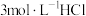 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。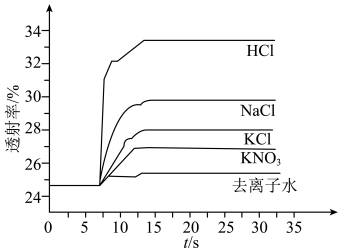
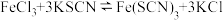 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近一年使用:0次
5 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。回答下列问题:
Ⅰ.如图是硫元素的“价—类”二维图。______ ; 属于
属于______ (填“酸性氧化物”或“碱性氧化物”)。
(2) 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
(3) 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是______ 。
Ⅱ.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证 的部分性质。
的部分性质。______ 。
(5)装置A中发生反应的化学方程式为______ ,该反应中氧化剂与还原剂的物质的量之比为______ 。
(6)装置B中湿润的品红溶液褪色,证明 有
有______ (填“漂白性”或“氧化性”);装置C中产生白色沉淀,该白色沉淀为______ (填化学式)。
Ⅰ.如图是硫元素的“价—类”二维图。
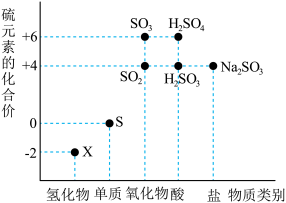
 属于
属于(2)
 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是______(填字母)。| A.把工厂烟囱造高 | B.煤使用之前先脱硫 |
| C.逐渐用新能源代替含硫煤 | D.加强空气中二氧化硫的监测 |
(3)
 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是Ⅱ.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证
 的部分性质。
的部分性质。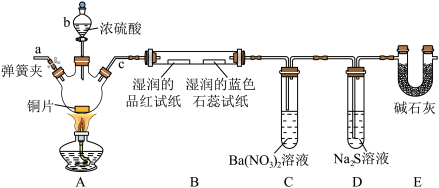
(5)装置A中发生反应的化学方程式为
(6)装置B中湿润的品红溶液褪色,证明
 有
有
您最近一年使用:0次
名校
解题方法
6 . 某小组用如下装置(夹持装置已略去)制备并探究 的性质。
的性质。 的化学方程式是
的化学方程式是___________ 。
(2)a中控制生成 多少的操作是
多少的操作是___________ ;反应后a中若溶液颜色无色,试管底部有灰白色固体,确定产物中有 的操作是
的操作是___________ 。
(3)b用于探究 的性质。
的性质。
①b中为___________ 溶液时,可证明 有漂白性。
有漂白性。
②b中为 和淀粉混合溶液时,溶液蓝色褪去,可证明
和淀粉混合溶液时,溶液蓝色褪去,可证明 有还原性,反应的化学方程式为
有还原性,反应的化学方程式为___________ 。
③b中为 溶液时,反应后在溶液中可检验出
溶液时,反应后在溶液中可检验出 ,说明检验
,说明检验 的方法是
的方法是___________ 。
④b中为 溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子
溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子 的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为
的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为___________ 。随着反应进行,又出现淡黄色沉淀,溶液黄色消失,这是由于溶液中的 与过量
与过量 又继续反应了,写出反应的离子方程式
又继续反应了,写出反应的离子方程式___________ 。
(资料: 能与S反应生成
能与S反应生成 ,
, 与酸反应生成S和
与酸反应生成S和 )。
)。
(4)c用于吸收 尾气,可选用的试剂是
尾气,可选用的试剂是___________ 。
A.NaOH溶液 B.澄清石灰水 C. 溶液
溶液
 的性质。
的性质。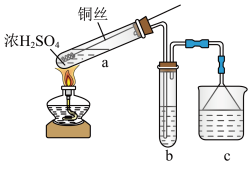
 的化学方程式是
的化学方程式是(2)a中控制生成
 多少的操作是
多少的操作是 的操作是
的操作是(3)b用于探究
 的性质。
的性质。①b中为
 有漂白性。
有漂白性。②b中为
 和淀粉混合溶液时,溶液蓝色褪去,可证明
和淀粉混合溶液时,溶液蓝色褪去,可证明 有还原性,反应的化学方程式为
有还原性,反应的化学方程式为③b中为
 溶液时,反应后在溶液中可检验出
溶液时,反应后在溶液中可检验出 ,说明检验
,说明检验 的方法是
的方法是④b中为
 溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子
溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子 的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为
的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为 与过量
与过量 又继续反应了,写出反应的离子方程式
又继续反应了,写出反应的离子方程式(资料:
 能与S反应生成
能与S反应生成 ,
, 与酸反应生成S和
与酸反应生成S和 )。
)。(4)c用于吸收
 尾气,可选用的试剂是
尾气,可选用的试剂是A.NaOH溶液 B.澄清石灰水 C.
 溶液
溶液
您最近一年使用:0次
解题方法
7 . 过氧化氢是淡蓝色的黏稠液体,可。与水以任意比例混溶,是一种强氧化剂。其一般以30%~60%的水溶液形式存放,水溶液俗称双氧水,适用于医用伤口消毒,环境消毒和食品消毒等。回答下列问题:
(1)实验室中利用反应2H2O2 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是___________ (填字母,下同),收集O2可选用的装置是___________ (填字母)。___________ mL(保留三位有效数字)。
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:___________
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
⑤数据分析、交流讨论。
实验结果:X2<X1<X3且X1=___________ ,测得pH数据中能证明上述猜想的是___________ (用X1、X2、X3的大小关系表示);pH出现X1<X3的原因是___________ 。
⑥优化实验。在20℃下进行下列实验:
若实验中测得△T1___________ △T2(填“>”或“<”),则说明H2O2电离过程吸热。
(1)实验室中利用反应2H2O2
 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是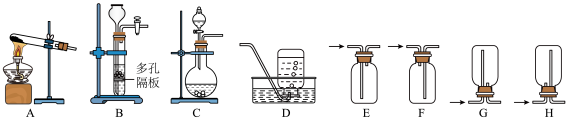
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
| 试祥 | 温度/℃ | pH | |
| 1 | 10mL1.5mol/L的双氧水 | 20 | X1 |
| 2 | 10mL1.5mol/L的双氧水 | 30 | X2 |
| 3 | 10mL1.5mol/L的双氧水 | 50 | X3 |
实验结果:X2<X1<X3且X1=
⑥优化实验。在20℃下进行下列实验:
| 试样 | 反应前后温度变化/℃ | |
| 4 | 10mL1.5mol/L的双氧水、10mL1.5mol/L的NaOH溶液 | △T1 |
| 5 | 10mL1.5mol/L的H2SO4溶液10mL1.5mol/L的NaOH溶液 | △T2 |
您最近一年使用:0次
解题方法
8 . Ⅰ.铸铁的主要成分为Fe和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。 、
、________ 。
(2)实验现象:①________ ,证明确实有SO2生成。
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明________ 。
(3)检测反应后A中所得溶液中含有 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加________ ,现象为________ 证明有 。
。
(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为________ 。
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将 还原为
还原为 的转化关系如下:
的转化关系如下:

(5)纳米Fe制备原理: ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是________ 。
(6)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是________ 。
(7)检验溶液中 的操作和现象是
的操作和现象是________ 。
(8)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是________ (答1条)。
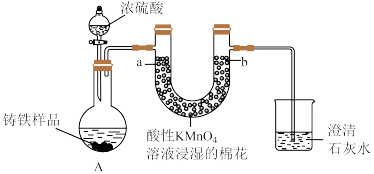
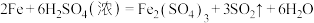 、
、(2)实验现象:①
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明
(3)检测反应后A中所得溶液中含有
 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加 。
。(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将
 还原为
还原为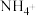 的转化关系如下:
的转化关系如下:
(5)纳米Fe制备原理:
 ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是(6)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(7)检验溶液中
 的操作和现象是
的操作和现象是(8)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是
您最近一年使用:0次
名校
解题方法
9 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
10 .  可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。
(1) 的制备
的制备
实验室可用 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:__________________________ 。
(2) 的收集
的收集
为收集纯净的 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→_______ →e。 的性质探究
的性质探究
ⅰ)探究 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: 的变化速率
的变化速率__________  。
。
②ab段变化及溶液的pH减小,表明 与水发生反应,其方程式为
与水发生反应,其方程式为_____________________ ,该反应的产物不稳定,可通过以下实验证明,请补充操作填在表格横线中。
若____________________ ,证明该反应产物不稳定。
ⅱ)探究 使品红溶液褪色的原因
使品红溶液褪色的原因
操作1:将 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。 、
、 、
、____________________ 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是 请完成表格。
请完成表格。
 可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。(1)
 的制备
的制备实验室可用
 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:(2)
 的收集
的收集为收集纯净的
 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→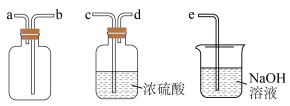
 的性质探究
的性质探究ⅰ)探究
 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: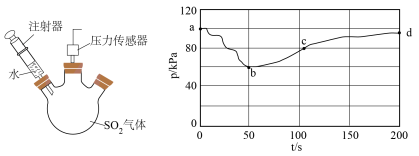
 的变化速率
的变化速率 。
。②ab段变化及溶液的pH减小,表明
 与水发生反应,其方程式为
与水发生反应,其方程式为操作 | 100s内压强变化/kPa |
待烧瓶中压强稳定后,将其置于热水浴中,重新测定压强变化 |
|
|
ⅱ)探究
 使品红溶液褪色的原因
使品红溶液褪色的原因操作1:将
 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。
 、
、 、
、已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是
 请完成表格。
请完成表格。操作2 | 现象 |
不褪色 |
您最近一年使用:0次