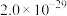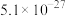甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(实验班)化学试题
甘肃
高二
期末
2021-02-18
318次
整体难度:
容易
考查范围:
化学与STSE、化学反应原理、常见无机物及其应用、化学实验基础、认识化学科学
一、单选题 添加题型下试题
A. 风力发电 风力发电 | B. 太阳能发电 太阳能发电 |
C. 火力发电 火力发电 | D. 潮汐能发电 潮汐能发电 |
【知识点】 能源开发利用新理念
①金属钠与水反应 ②NH4Cl晶体与Ba(OH)2·8H2O晶体混合搅拌 ③H2在Cl2中燃烧 ④液态水变成水蒸气 ⑤酸碱中和 ⑥碳酸钙热分解
| A.①②⑤ | B.①③⑤ | C.③④⑤ | D.②④⑥ |
| A.0.06 mol/(L·min) | B.0.04 mol/(L·min) |
| C.0.12 mol/(L·min) | D.0.24 mol/(L·min) |
| A.体系有序性越高,熵值就越低 | B.自发过程可以导致体系的熵增大 |
| C.吸热反应不可以自发进行 | D.同种物质气态时熵值最大 |
 的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为: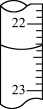
| A.22.20mL | B.22.35mL | C.23.65mL | D.23.90mL |
【知识点】 酸碱中和滴定实验相关仪器解读
| A.甲烷燃烧热为890.3 kJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJ•mol-1 |
| B.稀硫酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJ•mol-1 |
| C.H2燃烧热为285.8kJ•mol-1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ•mol-1 |
D.500℃、30 MPa下,将1 mol N2和3 mol H2置于密闭的容器中充分反应生成NH3(g),放热38.6 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6 kJ·mol-1 2NH3(g) △H=-38.6 kJ·mol-1 |
| A.用过氧化氢溶液制取氧气时,加少量MnO2以加快反应速率 |
| B.用标准HCl溶液滴定NaOH溶液来测定其浓度,选择酚酞为指示剂 |
| C.用铂丝蘸取某碱金属的化合物溶液灼烧火焰呈黄色,证明该化合物是钠盐 |
| D.给试管里的液体加热,液体体积一般不超过试管容积的三分之一 |
【知识点】 焰色试验解读 影响化学反应速率的因素 酸碱中和滴定 仪器使用与实验安全
| 选项 | 强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 |
| A | Ca(OH)2 | 酒精 | N2O5 | Na2O |
| B | CaSO4 | H2CO3 | SO2 | CaO |
| C | NaHCO3 | 氨水 | Mn2O7 | Al2O3 |
| D | HCl | HF | CO | Na2O2 |
| A.A | B.B | C.C | D.D |
| A.将混合气中的氨气液化分离,有利于合成氨的反应 |
| B.用过量氮气与氢气反应可以提高氢气的转化率 |
C.密闭容器中发生反应H2(g)+I2(g) 2HI(g),增大压强时容器中颜色加深 2HI(g),增大压强时容器中颜色加深 |
| D.加压有利于SO2与O2反应生成SO3 |
| A.滴入酚酞试液,NaNO2溶液显红色 |
| B.用HNO2溶液做导电实验,灯泡很暗 |
C.HNO2溶液中的微粒中有:HNO2、H+、NO 、OH-、H2O 、OH-、H2O |
| D.0.10 mol/L HNO2溶液的pH=2 |
| A.密闭容器中,2 mol SO2 和足量 O2 充分反应,SO3的分子数为 2 NA |
B.含 NA个 CO 的 Na2CO3 溶液中,Na+数目为 2 NA 的 Na2CO3 溶液中,Na+数目为 2 NA |
| C.11.2 L 甲烷和乙烯的混合物中含氢原子数目为 2 NA |
| D.44 g CO2 气体中含氧原子数目为 2 NA |
| A.NH4Al(SO4)2 | B.NH4Cl |
| C.NH3.H2O | D.CH3COONH4 |
【知识点】 弱电解质的电离平衡 盐溶液中离子浓度大小的比较解读
| 选项 | 实验目的及操作 | 误差分析 |
| A | 用pH 试纸测某稀酸溶液的pH 时,先润湿试纸 | 无影响 |
| B | 配制一定物质的量浓度的NaCl溶液时,仰视容量瓶刻度线 | 偏低 |
| C | 测定某酸的准确浓度时,碱式滴定管未用标准液润洗 | 偏低 |
| D | 测定中和热时,忘记盖上泡沫塑料板 | 无影响 |
| A.A | B.B | C.C | D.D |
| A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ |
| B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O |
C.电解MgCl2饱和溶液制取Mg:MgCl2 Mg+Cl2↑ Mg+Cl2↑ |
| D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42- |
【知识点】 离子方程式的正误判断解读 明矾的净水作用及原理解读 沉淀转化解读 电冶金解读
| A.活化分子之间发生的碰撞一定为有效碰撞 |
| B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| C.对有气体参加的化学反应增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
【知识点】 影响化学反应速率的因素 影响化学反应速率的外因 碰撞理论及活化能解读
 N2+3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应N2 + 3H2
N2+3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应N2 + 3H2 2NH3的平衡常数为
2NH3的平衡常数为| A.4 | B.2 | C.1 | D.0.5 |
【知识点】 化学平衡常数的有关计算解读
| A.5×10-13mol/L | B.0.02mol/L | C.1×10-7mol/L | D.1×10-12mol/L |
【知识点】 水的离子积常数解读 水溶液中水的电离程度及的计算解读

| A.由图a可知,T1>T2,该反应的正反应为放热反应 |
| B.由图b可知,该反应m+n<p |
| C.图c是绝热条件下速率和时间的图像,由此说明该反应吸热 |
| D.图d中,若m+n=p,则曲线a一定增大了压强 |
【知识点】 化学平衡图像分析
| A.升高温度,溶液的pH降低 |
| B.加入NaOH固体,溶液中的c(Na+)、c(S2-)均增大 |
| C.c(Na+)>c(S2-)>c(H+)>c(OH-) |
| D.2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
2H2O2(l)=2H2O(l)+O2(g) △H2
2H2(g)+O2(g)=2H2O(l) △H3
则反应Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l))的△H是( )
| A.△H=△H1+1/2△H2+1/2△H3 |
| B.△H=△H1+1/2△H2-1/2△H3 |
| C.△H=△H1+2△H2+2△H3 |
| D.△H=2△H1+△H2+△H3 |
【知识点】 盖斯定律及其有关计算
A. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
B.由水电离的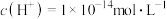 的溶液中: 的溶液中: 、 、 、 、 、 、 |
C. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.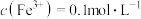 的溶液中: 的溶液中: 、 、 、 、 、 、 |
【知识点】 限定条件下的离子共存解读
| A.0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合 |
| B.0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合 |
| C.pH=3的硫酸和pH=11的氨水等体积混合 |
| D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合 |
【知识点】 酸碱混合时的定性判断及计算解读
 C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。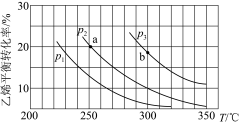
| A.乙烯气相直接水合反应的ΔH<0 |
| B.图中压强的大小关系为p1>p2>p3 |
C.图中a点对应的平衡常数K= |
| D.达到平衡状态a、b所需要的时间:a>b |
二、填空题 添加题型下试题
①2H2(g) +O2(g) = 2H2O(l) △H = -571.6 kJ / mol
②C(s) + O2(g) = CO2(g) △H = -393.5 kJ / mol
③C(s) + H2O(g) = CO(g) + H2(g) △H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)2g H2完全燃烧生成液态水,放出的热量为
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为
②已知HCN稀溶液与NaOH稀溶液反应生成1mol H2O时,放出12.1kJ热量,用离子方程式表示该反应的热化学方程为
(1)CH3COOH溶于水的电离方程式为
(2)0.05mol/LH2SO4溶液的pH为
(3)某温度下,水的离子积常数Kw=1×10-12,则此温度大于25℃,原因是
三、解答题 添加题型下试题
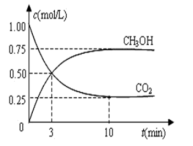
(1)若CO2的转化率为40%时,反应放出的热量为
(2)判断该可逆反应达到化学平衡状态的标志是
a.v生成(CH3OH)=v消耗(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO2、H2、CH3OH、H2O的浓度均不再变化
(3)下列表示该反应速率最快的是
a.v(H2)=2 mol·L-1·min-1
b.v(CO2)=4.5 mol·L-1·min-1
c.v(CH3OH)=3 mol·L-1·min-1
d.v(H2O)=0.2 mol·L-1·s-1
(4)该反应的平衡常数表达式为K=
 +5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。
+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、胶头滴管、
(2)滴定时,将KMnO4标准液装在图中的

(3)本实验滴定达到终点的标志是
(4)通过上述数据,计算出x=
(5)下列滴定操作会使测得的x值偏大的是
A.滴定终点时俯视滴定管刻度
B.滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 能源开发利用新理念 | |
| 2 | 0.85 | 吸热反应和放热反应 | |
| 3 | 0.85 | 化学反应速率计算 | |
| 4 | 0.94 | 化学反应自发过程 化学反应进行方向的判据 反应进行方向判据的应用 | |
| 5 | 0.85 | 酸碱中和滴定实验相关仪器 | |
| 6 | 0.65 | 中和热 热化学方程式书写及正误判断 表示燃烧热的热化学方程式书写 可逆反应及反应限度 | |
| 7 | 0.85 | 燃烧热概念 | |
| 8 | 0.65 | 焰色试验 影响化学反应速率的因素 酸碱中和滴定 仪器使用与实验安全 | |
| 9 | 0.65 | 酸、碱、盐、氧化物的概念及其相互联系 强电解质与弱电解质 | |
| 10 | 0.85 | 勒夏特列原理的应用 | |
| 11 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 盐类水解的原理 | |
| 12 | 0.65 | 22.4L/mol适用条件 根据n=m/M进行相关计算 可逆反应及反应限度 盐类水解的原理 | |
| 13 | 0.65 | 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |
| 14 | 0.65 | 中和热的测定与误差分析 测定溶液pH的方法 酸碱中和滴定的误差分析 | |
| 15 | 0.94 | 溶度积常数相关计算 | |
| 16 | 0.94 | 离子方程式的正误判断 明矾的净水作用及原理 沉淀转化 电冶金 | |
| 17 | 0.65 | 影响化学反应速率的因素 影响化学反应速率的外因 碰撞理论及活化能 | |
| 18 | 0.94 | 化学平衡常数的有关计算 | |
| 19 | 0.85 | 水的离子积常数 水溶液中水的电离程度及的计算 | |
| 20 | 0.65 | 化学平衡图像分析 | |
| 21 | 0.85 | 盐类水解的原理 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 22 | 0.65 | 盖斯定律及其有关计算 | |
| 23 | 0.65 | 限定条件下的离子共存 | |
| 24 | 0.94 | 酸碱混合时的定性判断及计算 | |
| 25 | 0.65 | 化学平衡图像分析 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的有关计算 | |
| 二、填空题 | |||
| 26 | 0.85 | 反应热与焓变概念比较 热化学方程式书写及正误判断 燃烧热概念 | |
| 27 | 0.85 | 水的离子积常数 pH定义式及计算 弱电解质的电离方程式 浓度对电离平衡的影响 | |
| 三、解答题 | |||
| 28 | 0.65 | 化学反应热的计算 化学反应速率计算 化学平衡状态的判断方法 化学平衡常数的有关计算 | 原理综合题 |
| 29 | 0.65 | 酸碱中和滴定原理的应用 探究物质组成或测量物质的含量 | 实验探究题 |

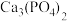 的饱和溶液中,
的饱和溶液中,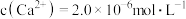 ,
,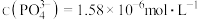 ,则
,则 为
为