名校
1 . Fe/Fe3O4磁性材料在很多领域具有应用前景,其制备过程如下(各步均在N2氛围中进行):
①称取9.95g FeCl2·4H2O(Mr =199),配成50mL溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入100mL14mol· L-1KOH溶液。
③持续磁力搅拌,将FeCl2溶液以2mL·min-1的速度全部滴入三颈烧瓶中,100°C 下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在40°C干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
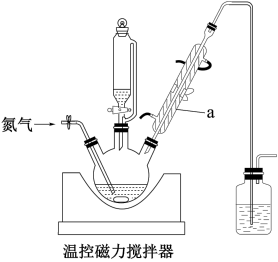
回答下列问题:
(1)仪器a的名称是_______ ;使用恒压滴液漏斗的原因是_______ 。
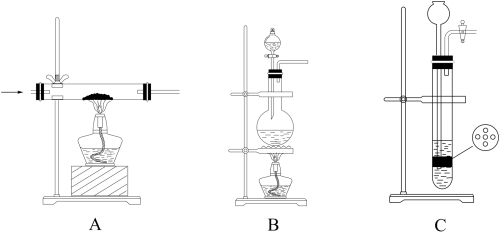
(2)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合以下供选试剂和装置,选出一种可行的方法,化学方程式为_______ ,对应的装置为_______ (填标号)。
可供选择的试剂:CuO(s)、 NH3(g)、 Cl2(g)、 O2(g)、 饱和NaNO2(aq)、饱和NH4Cl(aq)可供选择的发生装置(净化装置略去):
(3)三颈烧瓶中反应生成了Fe和Fe3O4,离子方程式为_______ 。
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
(5)步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为_______ ;
(6)该实验所得磁性材料的产率为_______ (保留 3位有效数字)。
①称取9.95g FeCl2·4H2O(Mr =199),配成50mL溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入100mL14mol· L-1KOH溶液。
③持续磁力搅拌,将FeCl2溶液以2mL·min-1的速度全部滴入三颈烧瓶中,100°C 下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在40°C干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)仪器a的名称是
(2)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合以下供选试剂和装置,选出一种可行的方法,化学方程式为
可供选择的试剂:CuO(s)、 NH3(g)、 Cl2(g)、 O2(g)、 饱和NaNO2(aq)、饱和NH4Cl(aq)可供选择的发生装置(净化装置略去):

(3)三颈烧瓶中反应生成了Fe和Fe3O4,离子方程式为
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
| A.采用适宜的滴液速度 |
| B.用盐酸代替KOH溶液,抑制Fe2+水解 |
| C.在空气氛围中制备 |
| D.选择适宜的焙烧温度 |
(6)该实验所得磁性材料的产率为
您最近一年使用:0次
2022-04-17更新
|
383次组卷
|
2卷引用:辽宁省沈阳市第五中学2021-2022学年高三下学期3月月考化学试题
名校
2 . 某实验小组测定铁的氧化物FexOy的化学式,已知该氧化物中铁元素只有+2和+3两种价态,实验步骤如图,下列说法正确的是
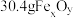

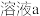
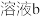
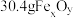

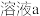
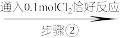
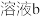
| A.步骤①和步骤②都发生了氧化还原反应 | B.溶液a中阳离子只有Fe3+和Fe2+ |
| C.溶液b中n(Fe3+):n(Cl-)=1:3 | D.通过计算可得该氧化物的化学式为:Fe4O5 |
您最近一年使用:0次
2022-03-03更新
|
632次组卷
|
3卷引用:河南省信阳市2021-2022学年高一上学期期末考试化学试题
河南省信阳市2021-2022学年高一上学期期末考试化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)江西省南昌市第二中学2023-2024学年高一上学期12月月考考试化学试题
3 . 黑色化合物M由两种常见的元素组成,各物质的转化关系如图所示。

回答下列问题:
(1)D是_______ (填化学式)。
(2)将A通入新制氯水中发生主要反应的离子方程式为_______ 。
(3)为了探究温度对D和氨气反应的产物的影响,设计实验:
①根据上述现象,得出实验结论:E为 (X表示形成化合物M的一种元素),F为
(X表示形成化合物M的一种元素),F为_______ (填化学式)。
②乙组实验中,步骤Ⅲ中溶液由无色变红的原因是_______ (用离子方程式表示)。
③通过交流、讨论,有人认为E中除 外还可能含
外还可能含_______ (填化学式),判断的理由是_______ 。

回答下列问题:
(1)D是
(2)将A通入新制氯水中发生主要反应的离子方程式为
(3)为了探究温度对D和氨气反应的产物的影响,设计实验:
| 步骤 | 操作 | E(甲组) | F(乙组) |
| Ⅰ | 取少量产物,加入稀盐酸 | 溶解、无气泡 | 溶解,有气泡 |
| Ⅱ | 取步骤Ⅰ中溶液,滴加KSCN溶液 | 溶液变红 | 无明显变化 |
| Ⅲ | 向步骤Ⅱ溶液中滴加双氧水 | 红色变深 | 溶液变红 |
 (X表示形成化合物M的一种元素),F为
(X表示形成化合物M的一种元素),F为②乙组实验中,步骤Ⅲ中溶液由无色变红的原因是
③通过交流、讨论,有人认为E中除
 外还可能含
外还可能含
您最近一年使用:0次
解题方法
4 . A、B、C、D均为中学化学常见的纯净物且都含有一种相同元素,A是单质,B是A的氧化物。它们有如图反应关系:
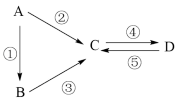
(1)若B是淡黄色固体,②③的反应中均有一种相同的反应物且摩尔质量为18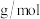 ,D俗称小苏打。则C的化学式为
,D俗称小苏打。则C的化学式为___________ ,由D和少量澄清石灰水反应可得到苏打,写出该反应的离子方程式___________ 。
(2)若B是红棕色固体,反应③在盐酸中完成,则反应②中加入物质的化学式为___________ ;若C、D组成元素相同,且无其他元素参与相互转化,则C转化为D的离子方程式为___________ ;在D中滴入氢氧化钠溶液,一段时间内观察到的现象是___________ 。

(1)若B是淡黄色固体,②③的反应中均有一种相同的反应物且摩尔质量为18
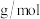 ,D俗称小苏打。则C的化学式为
,D俗称小苏打。则C的化学式为(2)若B是红棕色固体,反应③在盐酸中完成,则反应②中加入物质的化学式为
您最近一年使用:0次
解题方法
5 . 下列离子方程式正确的是
A. 溶于水: 溶于水: |
B.氢氧化镁与稀盐酸反应: |
C. 与氯化亚铁溶液: 与氯化亚铁溶液: |
D.向含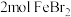 溶液中通入 溶液中通入 : : |
您最近一年使用:0次
名校
6 . 某小组探究CuSO4溶液、FeSO4溶液与碱的反应,探究物质氧化性和还原性的变化规律。将一定浓度CuSO4溶液,饱和FeSO4混合溶液加入适量氨水,产生红褐色沉淀,经检验,红褐色沉淀含Fe(OH)3。
(1)分析Fe(OH)3产生的原因:O2氧化所致。
验证:向FeSO4溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
①生成白色沉淀的离子方程式是___________ 。
②产生红褐色沉淀:4Fe(OH)2+O2+2H2O=4Fe(OH)3。电极反应式:还原反应:O2+2H2O+4e-=4OH-。氧化反应:___________ 。
(2)提出问题:产生Fe(OH)3的原因可能是Cu2+氧化所致。
验证如下(溶液A:饱和FeSO4溶液+CuSO4溶液;已排除空气的影响):
①I中可能产生Cu,运用氧化还原反应规律分析产生Cu的合理性:___________ 。
②检验:滤出I中不溶物,用稀H2SO4溶解,未检出Cu。分析原因:
i.I中未生成Cu。
iiI中生成了Cu。由于___________ (用离子方程式表示),因此未检出Cu。
(3)设计实验(III)确认CuSO4的作用(已排除空气的影响),装置示意图如下所示。
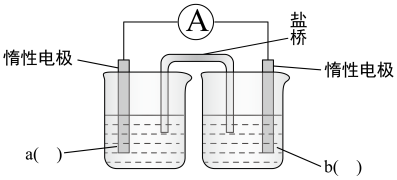
①补全电化学装置示意图___________ 。经检验,实验中产生了Fe(OH)3、Cu。
②II、III中均含Cu2+。III中产生了Cu,II中未产生Cu,试解释原因___________ 。
(4)CH3CHO分别与AgNO3溶液、银氨溶液混合并加热,CH3CHO与AgNO3溶液混合物明显现象,但与银氨溶液混合能产生银镜。试解释原因:___________ 。
(1)分析Fe(OH)3产生的原因:O2氧化所致。
验证:向FeSO4溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
①生成白色沉淀的离子方程式是
②产生红褐色沉淀:4Fe(OH)2+O2+2H2O=4Fe(OH)3。电极反应式:还原反应:O2+2H2O+4e-=4OH-。氧化反应:
(2)提出问题:产生Fe(OH)3的原因可能是Cu2+氧化所致。
验证如下(溶液A:饱和FeSO4溶液+CuSO4溶液;已排除空气的影响):
| 序号 | 实验 | 试剂 | 现象 |
| I | 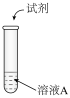 | 氨水 | 生成沉淀,一段时间后,产生红褐色沉淀和灰黑色固体物质 |
| II | 水 | 溶液无明显变化 |
②检验:滤出I中不溶物,用稀H2SO4溶解,未检出Cu。分析原因:
i.I中未生成Cu。
iiI中生成了Cu。由于
(3)设计实验(III)确认CuSO4的作用(已排除空气的影响),装置示意图如下所示。

①补全电化学装置示意图
②II、III中均含Cu2+。III中产生了Cu,II中未产生Cu,试解释原因
(4)CH3CHO分别与AgNO3溶液、银氨溶液混合并加热,CH3CHO与AgNO3溶液混合物明显现象,但与银氨溶液混合能产生银镜。试解释原因:
您最近一年使用:0次
2022-01-16更新
|
1080次组卷
|
8卷引用:北京市朝阳区2021-2022学年高三上学期期末考试化学试题
解题方法
7 . 实验室测定氧化物X(FexO)的组成实验如下:

下列有关说法正确的是

下列有关说法正确的是
| A.根据步骤I、II可判断X的组成为Fe0.8O |
| B.溶液Y中c(Fe2+):c(Fe3+)=1:2 |
| C.溶液Z中的离子只有Fe3+和Cl- |
| D.样品X中氧元素的质量分数约为27.6% |
您最近一年使用:0次
2022-01-13更新
|
467次组卷
|
2卷引用:辽宁省协作校2021-2022学年高一上学期期末考试化学试题
名校
解题方法
8 . 8.34gFeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
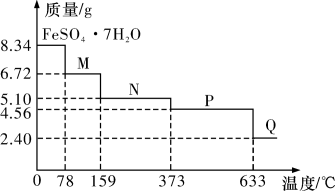

| A.温度为78℃时固体物质M的化学式为FeSO4·5H2O |
| B.温度为159℃时固体N的化学式为FeSO4·2H2O |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O FeSO4+H2O FeSO4+H2O |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时只得到一种无色气体生成 |
您最近一年使用:0次
2021-11-04更新
|
1707次组卷
|
6卷引用:江西省奉新县第一中学2021-2022学年上学期高三第一次月考化学试题
江西省奉新县第一中学2021-2022学年上学期高三第一次月考化学试题(已下线)专题36 物质的制备及实验方案的设计与评价(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第三章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河南省南阳市2022-2023学年高一上学期1月期末考试化学试题(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)河南省南阳市唐河县第一高级中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
9 . 溶液A中存在Ba2+、Fe2+、Al3+、Fe3+、Cu2+、 、
、 、Cl-、
、Cl-、 、
、 中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。

已知:下表为相应阳离子形成氢氧化物沉淀时所对应的pH范围
请回答下列问题:
(1)溶液A中含有的离子为___________ 。
(2)反应①的离子方程式为___________ 。
(3)沉淀甲是___________ ,沉淀乙是___________ (填化学式)。
(4)固体C可能是___________ (填字母)。
a.CuO b.Cu(OH)2 c.CuSO4 d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式___________ 。
(6)若向原溶液A中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为___________ g。
 、
、 、Cl-、
、Cl-、 、
、 中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
已知:下表为相应阳离子形成氢氧化物沉淀时所对应的pH范围
| 阳离子 | 开始沉淀时pH | 沉淀完全时pH |
| Fe2+ | 5.9 | 8.4 |
| Fe3+ | 1.1 | 3.0 |
| Cu2+ | 4.2 | 6.7 |
| Al3+ | 3.0 | 4.7 |
(1)溶液A中含有的离子为
(2)反应①的离子方程式为
(3)沉淀甲是
(4)固体C可能是
a.CuO b.Cu(OH)2 c.CuSO4 d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式
(6)若向原溶液A中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为
您最近一年使用:0次
名校
解题方法
10 . 纳米 在磁流体等领域有应用。一种制备纳米
在磁流体等领域有应用。一种制备纳米 的方法如下:
的方法如下:
Ⅰ. 的氧化:常温,将
的氧化:常温,将 溶液用
溶液用 溶液调节
溶液调节 至
至 ,再加入
,再加入 溶液,得到
溶液,得到 红棕色悬浊液。
红棕色悬浊液。
(1)①若用 溶液调节
溶液调节 过高会产生白色沉淀,该反应的离子方程式是
过高会产生白色沉淀,该反应的离子方程式是___________ 。
上述反应完成后,测得 值与
值与 产率及其生成后溶液
产率及其生成后溶液 的关系,结果如下:
的关系,结果如下:
②用离子方程式解释 生成后溶液
生成后溶液 下降的原因:
下降的原因:___________ 。
③当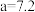 时,产物中存在大量
时,产物中存在大量 。对
。对 的产生提出两种假设:
的产生提出两种假设:
假设ⅰ:反应过程中溶液酸性增强,导致 向
向 转化。
转化。
假设ⅱ:溶液中存在少量 ,导致
,导致 向
向 转化。
转化。
经分析假设ⅰ不成立。其实验依据是___________ 。
为验证假设ⅱ,其他条件相同时,向 浊液中加入不同浓度
浊液中加入不同浓度 ,
, 后测定物质的组成,结果如下:
后测定物质的组成,结果如下:
④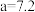 和
和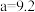 时,
时, 产率差异很大的原因是
产率差异很大的原因是___________ 。
Ⅱ. 和
和 共沉淀:向
共沉淀:向 红棕色悬浊液中同时加入
红棕色悬浊液中同时加入 溶液和
溶液和 浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米
浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米 。
。
(2)共沉淀时的反应条件对产物纯度和产率有影响。
①共沉淀 过低时,得到的纳米
过低时,得到的纳米 中会混有的物质是
中会混有的物质是___________ 。
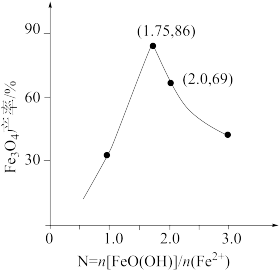
②已知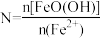 ,其他条件一定时,测得纳米
,其他条件一定时,测得纳米 的产率随
的产率随 的变化曲线如图所示。经理论分析,
的变化曲线如图所示。经理论分析, 时纳米
时纳米 产率应最高,事实并非如此的可能原因是
产率应最高,事实并非如此的可能原因是___________ 。
 在磁流体等领域有应用。一种制备纳米
在磁流体等领域有应用。一种制备纳米 的方法如下:
的方法如下:Ⅰ.
 的氧化:常温,将
的氧化:常温,将 溶液用
溶液用 溶液调节
溶液调节 至
至 ,再加入
,再加入 溶液,得到
溶液,得到 红棕色悬浊液。
红棕色悬浊液。(1)①若用
 溶液调节
溶液调节 过高会产生白色沉淀,该反应的离子方程式是
过高会产生白色沉淀,该反应的离子方程式是上述反应完成后,测得
 值与
值与 产率及其生成后溶液
产率及其生成后溶液 的关系,结果如下:
的关系,结果如下: | 7.2 | 8.2 | 9.2 |
 的产率 的产率 | 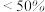 | 95% | 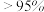 |
 生成后的 生成后的 | 约4 | 约4 | 约4 |
 生成后溶液
生成后溶液 下降的原因:
下降的原因:③当
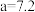 时,产物中存在大量
时,产物中存在大量 。对
。对 的产生提出两种假设:
的产生提出两种假设:假设ⅰ:反应过程中溶液酸性增强,导致
 向
向 转化。
转化。假设ⅱ:溶液中存在少量
 ,导致
,导致 向
向 转化。
转化。经分析假设ⅰ不成立。其实验依据是
为验证假设ⅱ,其他条件相同时,向
 浊液中加入不同浓度
浊液中加入不同浓度 ,
, 后测定物质的组成,结果如下:
后测定物质的组成,结果如下: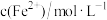 |  含量% 含量% |  含量% 含量% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
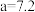 和
和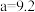 时,
时, 产率差异很大的原因是
产率差异很大的原因是Ⅱ.
 和
和 共沉淀:向
共沉淀:向 红棕色悬浊液中同时加入
红棕色悬浊液中同时加入 溶液和
溶液和 浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米
浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米 。
。(2)共沉淀时的反应条件对产物纯度和产率有影响。
①共沉淀
 过低时,得到的纳米
过低时,得到的纳米 中会混有的物质是
中会混有的物质是②已知
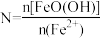 ,其他条件一定时,测得纳米
,其他条件一定时,测得纳米 的产率随
的产率随 的变化曲线如图所示。经理论分析,
的变化曲线如图所示。经理论分析, 时纳米
时纳米 产率应最高,事实并非如此的可能原因是
产率应最高,事实并非如此的可能原因是
您最近一年使用:0次



