1 .  是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。
(1) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(2)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知 能发生如下反应:
能发生如下反应: 。
。
上述反应中氧化剂是___________ ,氧化产物是___________ ;HI在反应中体现了___________ 性
②根据上述反应鉴别 和NaCl。可选用的物质有
和NaCl。可选用的物质有___________ (填序号)
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
③某厂废液中含有3%—6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ 。
A.浓硫酸 B. C.
C. D.
D.
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的 ,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为___________ 。
 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。(1)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式(2)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
①已知
 能发生如下反应:
能发生如下反应: 。
。上述反应中氧化剂是
②根据上述反应鉴别
 和NaCl。可选用的物质有
和NaCl。可选用的物质有A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
③某厂废液中含有3%—6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.浓硫酸 B.
 C.
C. D.
D.
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的
 ,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
您最近一年使用:0次
2 . 某化学兴趣小组按如图所示,在电炉加热时用纯氧氧化硬质玻璃管内有机样品,根据产物的质量确定有机物的组成。
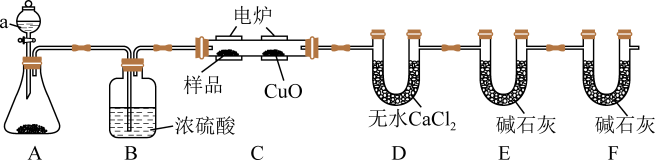
回答下列问题:
(1)仪器a的名称为_______ ,若装置A的锥形瓶内固体为MnO2,则a中的液体为_______ 。
(2)B装置中浓硫酸的作用是_______ ,燃烧管C中CuO的作用是_______ 。
(3)试判断装置D和装置E中的药品能否互换?_______ (试回答“能”或“否”及判断理由)。
(4)装置F的作用是_______ 。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,D管质量增加1.08g,E管质量增加1.76g,则该样品的实验式为_______ ;能否根据该实验式确定有机物的分子式?_______ (填“能”或“不能”),若能,则样品的分子式是_______ (若不能,则此空不填)。
(6)若该样品的核磁共振氢谱如图所示,则其结构简式为_______ 。


回答下列问题:
(1)仪器a的名称为
(2)B装置中浓硫酸的作用是
(3)试判断装置D和装置E中的药品能否互换?
(4)装置F的作用是
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,D管质量增加1.08g,E管质量增加1.76g,则该样品的实验式为
(6)若该样品的核磁共振氢谱如图所示,则其结构简式为

您最近一年使用:0次
3 . 三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化。实验室制备三氯化铬的流程如下:

还原反应在图甲所示装置中进行,制备过程在图乙所示装置中进行:

(1)图甲中仪器b的主要作用除导气外,还有___________ 。
(2)“还原”过程中会有CO2产生,请写出该反应的离子方程式:___________ 。
(3)A中的试剂为___________ ;无水CaCl2的作用是___________ ;反应结束后继续通入一段时间氮气,主要目的是___________ 。
(4)装置E用来收集产物,实验过程中若D处出现堵塞,可通过___________ (填操作),使实验能继续进行。
(5)样品中三氯化铬质量分数的测定
已知:CrCl3在水中易形成稳定的络离子[Cr(H2O)5Cl]2+; (白色沉淀);三氯化铬样品中的杂质不参与反应。
(白色沉淀);三氯化铬样品中的杂质不参与反应。
实验步骤如下:
①称取a g样品于锥形瓶中,加入水配成溶液。
②向锥形瓶中加入b mol/L的AgNO3溶液c mL,使溶液中Cl-完全沉淀。
③过滤除去AgCl沉淀,并用稀HNO3洗涤沉淀,将洗涤液合并在滤液中。
④加入2~3滴Fe(NO3)3溶液做指示剂,用d mol/L NH4SCN标准溶液反滴定过量Ag+至终点,记下所用NH4SCN溶液的体积为e mL。
Ⅰ.确定步骤②中Cl-已经完全沉淀的操作与现象为___________ 。
Ⅱ.若步骤③中未用稀HNO3洗涤沉淀,则测定的三氯化铬质量分数将___________ (填“偏大”“偏小”或“无法确定”)。
Ⅲ.样品中三氯化铬的质量分数为___________ (用含a、b、c、d、e的代数式表示)。

还原反应在图甲所示装置中进行,制备过程在图乙所示装置中进行:

(1)图甲中仪器b的主要作用除导气外,还有
(2)“还原”过程中会有CO2产生,请写出该反应的离子方程式:
(3)A中的试剂为
(4)装置E用来收集产物,实验过程中若D处出现堵塞,可通过
(5)样品中三氯化铬质量分数的测定
已知:CrCl3在水中易形成稳定的络离子[Cr(H2O)5Cl]2+;
 (白色沉淀);三氯化铬样品中的杂质不参与反应。
(白色沉淀);三氯化铬样品中的杂质不参与反应。实验步骤如下:
①称取a g样品于锥形瓶中,加入水配成溶液。
②向锥形瓶中加入b mol/L的AgNO3溶液c mL,使溶液中Cl-完全沉淀。
③过滤除去AgCl沉淀,并用稀HNO3洗涤沉淀,将洗涤液合并在滤液中。
④加入2~3滴Fe(NO3)3溶液做指示剂,用d mol/L NH4SCN标准溶液反滴定过量Ag+至终点,记下所用NH4SCN溶液的体积为e mL。
Ⅰ.确定步骤②中Cl-已经完全沉淀的操作与现象为
Ⅱ.若步骤③中未用稀HNO3洗涤沉淀,则测定的三氯化铬质量分数将
Ⅲ.样品中三氯化铬的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 碳酸锰(MnCO3)是制造电信器材软磁铁氧体的原料。实验室可用 制备
制备 。
。
已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化。
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化。
Ⅰ.碳酸锰的制备
(1)向 浊液中通入
浊液中通入 ,制备
,制备 溶液,实验装置如下图所示。
溶液,实验装置如下图所示。

①反应过程中为使 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定的前提下,还可以采取的合理措施有
比例一定的前提下,还可以采取的合理措施有_______ (任写一种)。
②A装置的作用是_______ 。
③实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是_______ 。
(2)将上述制得的 溶液加入到适量
溶液加入到适量 溶液中,制得
溶液中,制得 。
。
①生成 的离子方程式为
的离子方程式为_______ ;若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有_______ (填化学式)。
②反应完全后,将三颈烧瓶中的混合物经过滤、洗涤、干燥得到 产品。洗涤时须分别用蒸馏水和乙醇洗涤,用乙醇洗涤的目的是
产品。洗涤时须分别用蒸馏水和乙醇洗涤,用乙醇洗涤的目的是_______ 。
Ⅱ.碳酸锰热分解产物研究
(3)利用重量法探究 的热分解,相关数据如下表。
的热分解,相关数据如下表。
第一组热分解实验的产物为_______ ;
第二组热分解实验的化学方程式为_______ 。
 制备
制备 。
。已知:
 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化。
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化。Ⅰ.碳酸锰的制备
(1)向
 浊液中通入
浊液中通入 ,制备
,制备 溶液,实验装置如下图所示。
溶液,实验装置如下图所示。
①反应过程中为使
 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定的前提下,还可以采取的合理措施有
比例一定的前提下,还可以采取的合理措施有②A装置的作用是
③实验中若将
 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是(2)将上述制得的
 溶液加入到适量
溶液加入到适量 溶液中,制得
溶液中,制得 。
。①生成
 的离子方程式为
的离子方程式为 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有②反应完全后,将三颈烧瓶中的混合物经过滤、洗涤、干燥得到
 产品。洗涤时须分别用蒸馏水和乙醇洗涤,用乙醇洗涤的目的是
产品。洗涤时须分别用蒸馏水和乙醇洗涤,用乙醇洗涤的目的是Ⅱ.碳酸锰热分解产物研究
(3)利用重量法探究
 的热分解,相关数据如下表。
的热分解,相关数据如下表。| 实验 | 样品质量/g | 加热至 后质量/g 后质量/g |
| 第一组(氩气氛围) | 4.60 | 2.84 |
| 第二组(空气氛围) | 4.60 | 3.48 |
第二组热分解实验的化学方程式为
您最近一年使用:0次
名校
5 . 某化学兴趣小组的同学准备探究钠及其化合物的相关性质,请按要求填空:
(1)Na、Na2O、Na2O2和NaOH久置在空气中最终都是变为______________ (填化学式);
(2)将一小块金属Na投入CuSO4溶液中,现象为________________________________ ;
(3)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为________________________ (用离子方程式及必要的文字说明)。将带火星的木条伸入试管中,木条未复燃,向试管中加入少许黑色MnO2粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物__________ ;并由此推测Na2O2和水的反应是分两步进行的,写出其第一步反应的化学方程式___________________ ;
(4)现有一种以NaHCO3为主要成分的食品膨松剂,由于存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接好装置,________ ,装入相应药品进行实验。

已知:碱石灰是固体氢氧化钠和氧化钙组成的混合物。
实验过程:将样品m1 g装入样品管B,测定实验前D装置的质量m2 g打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________ ,待C中不再产生气泡,冷却至室温,拆下装置,再次称量D的质量为m3 g,则混合物中NaHCO3的质量分数为_______________ (用含m1 、m2
、m2 、m3
、m3 的代数式表示),若实验前该膨松剂受潮,则最终实验结果
的代数式表示),若实验前该膨松剂受潮,则最终实验结果___________ (填“偏大”、“偏小”或“不变”)。
(1)Na、Na2O、Na2O2和NaOH久置在空气中最终都是变为
(2)将一小块金属Na投入CuSO4溶液中,现象为
(3)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为
(4)现有一种以NaHCO3为主要成分的食品膨松剂,由于存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接好装置,

已知:碱石灰是固体氢氧化钠和氧化钙组成的混合物。
实验过程:将样品m1 g装入样品管B,测定实验前D装置的质量m2 g打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
 、m2
、m2 、m3
、m3 的代数式表示),若实验前该膨松剂受潮,则最终实验结果
的代数式表示),若实验前该膨松剂受潮,则最终实验结果
您最近一年使用:0次
名校
6 . 在饲料添加剂中常用到碘酸钙,制备碘酸钙晶体的流程如下:

已知:碘酸钙在不同温度下的存在形态
(1)KOH的电子式为_______ 。
(2)反应1在85℃中进行,应当选用的加热方法为_______ 。温度不能太高的原因是_______ 。反应Ⅰ的其中一种产物是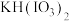 ,写出反应1的化学方程式
,写出反应1的化学方程式_______ 。
(3)操作2的名称为_______ ;醇洗的目的是_______ 。
(4)测定产品纯度的实验步骤如下:
准确称取产品mg,置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入500mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/L 标准溶液滴定至浅黄色,加入
标准溶液滴定至浅黄色,加入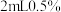 淀粉溶液,继续滴定至终点,重复实验2次,平均消耗
淀粉溶液,继续滴定至终点,重复实验2次,平均消耗 ,标准溶液nmL。
,标准溶液nmL。
滴定过程中发生的反应如下: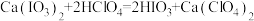 、
、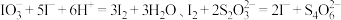
①滴定至终点的现象是_______ 。
②该样品中纯度为_______ 。(用含m、n的式子表示)

已知:碘酸钙在不同温度下的存在形态
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
(1)KOH的电子式为
(2)反应1在85℃中进行,应当选用的加热方法为
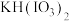 ,写出反应1的化学方程式
,写出反应1的化学方程式(3)操作2的名称为
(4)测定产品纯度的实验步骤如下:
准确称取产品mg,置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入500mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/L
 标准溶液滴定至浅黄色,加入
标准溶液滴定至浅黄色,加入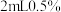 淀粉溶液,继续滴定至终点,重复实验2次,平均消耗
淀粉溶液,继续滴定至终点,重复实验2次,平均消耗 ,标准溶液nmL。
,标准溶液nmL。滴定过程中发生的反应如下:
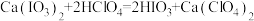 、
、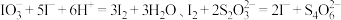
①滴定至终点的现象是
②该样品中纯度为
您最近一年使用:0次
名校
7 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为_______ ;装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:
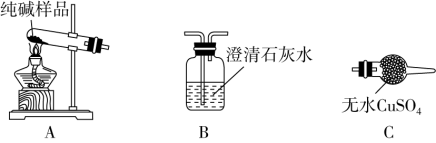
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:

| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
名校
解题方法
8 . 蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是:____ 。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行研究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是_____ 。
②装置D的作用是____ 。
③当装置B、C、E、F依次出现下列现象:____ ,品红溶液褪色,____ ,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。
结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2S2O +I2=S4O
+I2=S4O +2I—。
+2I—。
(3)写出二氧化硫与碘水反应的化学方程式:____ 。
(4)取蛋白质样品mg进行测定,采用c1mol·L–1的碘水V1mL进行吸收,滴定过量的碘时消耗c2mol·L–1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为____ 。
(5)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值____ (填“偏大”或“偏小”或“无影响”)。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是:
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行研究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是
②装置D的作用是
③当装置B、C、E、F依次出现下列现象:
结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2S2O
 +I2=S4O
+I2=S4O +2I—。
+2I—。(3)写出二氧化硫与碘水反应的化学方程式:
(4)取蛋白质样品mg进行测定,采用c1mol·L–1的碘水V1mL进行吸收,滴定过量的碘时消耗c2mol·L–1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为
(5)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值
您最近一年使用:0次
名校
9 . 叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。请回答以下问题:
I.制备氨基钠(反应原理为:2Na+2NH3 2NaNH2+H2)实验装置如图甲。
2NaNH2+H2)实验装置如图甲。
已知:氨基钠极易水解且易被空气氧化
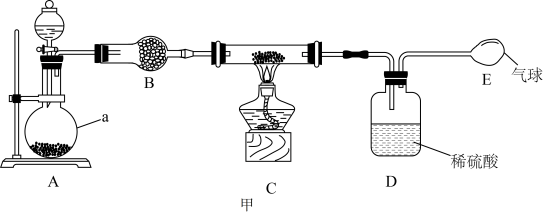
(1)仪器a的名称为___________ 。实验开始时,应先打开分液漏斗使浓氨水流下,目的是___________
(2)①B装置中的药品可选用___
A.P2O5 B.碱石灰 C.无水硫酸铜 D.无水氯化钙
②若无B装置,C中生成的氨基钠会发生的反应为___ (用化学方程式表示)
(3)某同学认为上述实验设计有缺陷,请对装置提出改正措施___
II.制备NaN3
(4)将I中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质的原因是___________
III.测定NaN3的纯度
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。
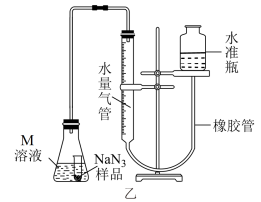
已知:2NaN3~3N2(其他产物略 ,反应中放出大量的热。
,反应中放出大量的热。
(5)对量气管读数时,反应前后都需要进行的操作是___________
(6)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为___________ 。(保留三位有效数字)
I.制备氨基钠(反应原理为:2Na+2NH3
 2NaNH2+H2)实验装置如图甲。
2NaNH2+H2)实验装置如图甲。已知:氨基钠极易水解且易被空气氧化

(1)仪器a的名称为
(2)①B装置中的药品可选用
A.P2O5 B.碱石灰 C.无水硫酸铜 D.无水氯化钙
②若无B装置,C中生成的氨基钠会发生的反应为
(3)某同学认为上述实验设计有缺陷,请对装置提出改正措施
II.制备NaN3
(4)将I中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质的原因是
III.测定NaN3的纯度
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。

已知:2NaN3~3N2(其他产物略
 ,反应中放出大量的热。
,反应中放出大量的热。(5)对量气管读数时,反应前后都需要进行的操作是
(6)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为
您最近一年使用:0次
2021-11-07更新
|
269次组卷
|
2卷引用:重庆市第八中学校2021-2022学年高三上学期第二次月考化学试题
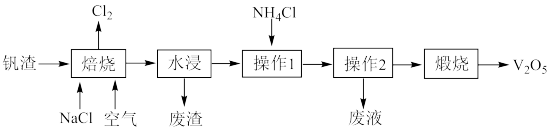
10 . 用工业钒渣(含 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
已知:
① 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。
② 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。
(1)硫酸工业中, 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为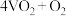
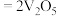 ,则第一步方程式为
,则第一步方程式为_______ 。
(2)“焙烧”过程的产物之一为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:_______ 。废渣的主要成分为氧化铁和_______ 。
(3)“操作1”需要加入过量氯化铵,其目的是_______ ;实验室完成“操作2”时需要用到的玻璃仪器有_______ ;若操作后得到的目标产物纯度不够,则提纯目标产物的方法是_______ 。
(4)“煅烧”中,除生成 外,还生成
外,还生成_______ 。
(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得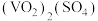 溶液;
溶液;
②加入b
 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: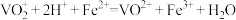
③过量的 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。
当加入最后一滴 溶液时,溶液变为
溶液时,溶液变为_______ ,且半分钟内不恢复原色,说明达到滴定终点。假设杂质不参与反应,则产品中 的质量分数为
的质量分数为_______ %。
 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
已知:
①
 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。②
 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。(1)硫酸工业中,
 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为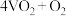
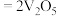 ,则第一步方程式为
,则第一步方程式为(2)“焙烧”过程的产物之一为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(3)“操作1”需要加入过量氯化铵,其目的是
(4)“煅烧”中,除生成
 外,还生成
外,还生成(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得
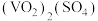 溶液;
溶液;②加入b

 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: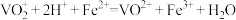
③过量的
 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。当加入最后一滴
 溶液时,溶液变为
溶液时,溶液变为 的质量分数为
的质量分数为
您最近一年使用:0次
2022-05-22更新
|
185次组卷
|
2卷引用:重庆市第八中学校2022届高三高考适应性月考卷(七)化学试题



