1 . 在标准状况下,进行甲、乙、丙三组实验,三组实验各取30mL同浓度的盐酸,加入同一种镁、铝混合物粉末,产生气体,有关数据列表如下:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?_____________,理由是_____________。
(2)盐酸的物质的量浓度_____________。
(3)混合粉末中Mg的物质的量为_______________,Mg、Al的物质的量之比为__________。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 1020 |
| 气体体积/mL | 560 | 672 | 672 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?_____________,理由是_____________。
(2)盐酸的物质的量浓度_____________。
(3)混合粉末中Mg的物质的量为_______________,Mg、Al的物质的量之比为__________。
您最近一年使用:0次
2 . 实验室中经常需配制一定浓度的NaOH溶液,现将22.0g NaOH固体溶于水配成100.0mL溶液,其密度为1.2g.mL﹣1.
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
(1)该溶液中NaOH的质量分数约为 .
(2)从该溶液中取出10.0mL,其中NaOH的物质的量浓度为 ,含NaOH的物质的量为 .
(3)将取出的10.0mL溶液加水稀释到100.0mL,稀释后溶液中NaOH的物质的量浓度为 .
您最近一年使用:0次
3 . 已知20℃时,磷酸与氢氧化钙生成的三种盐的溶解度(每升饱和溶液中含溶质的质量)如下表所示:
下列叙述正确的是
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g·L-1) | 2×10-2 | 4.303×10-2 | 18 |
下列叙述正确的是
| A.含Ca(H2PO4)2的磷肥可以与草木灰混施 |
| B.Ksp[CaHPO4]=c(Ca2+)·c(H+)·c(PO43-) |
| C.20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol·L-1 |
| D.向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
您最近一年使用:0次
4 . (1)将7.8gNa2O2加入100g水中,充分反应后得到密度为1.02g/cm3的溶液。
①溶液的质量分数为____________ (保留3位小数)。
②溶液的物质的量浓度为______________ mol/L(保留2位小数)。
(2)有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为0.3150,氯为0.2708,为求算Na2CO3的质量分数,某同学列了以下关系式:(31.50÷23)+(100-31.50-27.08-x)÷39=(27.08÷35.5)+x÷60×2,解得x=28.25,则Na2CO3的质量分数为____________ (保留3位小数)。
(3)含不溶杂质的NaNO3样品,加入一定量蒸馏水使其充分溶解,情况如下:
NaNO3溶解度(g/100g水)如下:
①实验中加入的水为______________________ g;
②原样品中NaNO3为______________________ g。
(4)在450℃、1.50×107Pa条件下,Na2O与O2反应生成NaO 2,NaO 2可用于应急呼吸面罩:4NaO2+2CO 2=2Na2CO3+3O2、4NaO2+2H2O (g)+4CO2=4NaHCO3+3O2;某呼吸面罩中放置了500g NaO2,吸收CO2和H2O(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g。计算生成的Na2CO3和NaHCO3物质的量之比_____________ 。
①溶液的质量分数为
②溶液的物质的量浓度为
(2)有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为0.3150,氯为0.2708,为求算Na2CO3的质量分数,某同学列了以下关系式:(31.50÷23)+(100-31.50-27.08-x)÷39=(27.08÷35.5)+x÷60×2,解得x=28.25,则Na2CO3的质量分数为
(3)含不溶杂质的NaNO3样品,加入一定量蒸馏水使其充分溶解,情况如下:
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
NaNO3溶解度(g/100g水)如下:
| 温度(℃) | 10 | 40 | 70 |
| 溶解度 | 81 | 104 | 150 |
①实验中加入的水为
②原样品中NaNO3为
(4)在450℃、1.50×107Pa条件下,Na2O与O2反应生成NaO 2,NaO 2可用于应急呼吸面罩:4NaO2+2CO 2=2Na2CO3+3O2、4NaO2+2H2O (g)+4CO2=4NaHCO3+3O2;某呼吸面罩中放置了500g NaO2,吸收CO2和H2O(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g。计算生成的Na2CO3和NaHCO3物质的量之比
您最近一年使用:0次
5 . 工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________ ,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______ (保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________ m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________ 。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
您最近一年使用:0次
2015-06-02更新
|
418次组卷
|
2卷引用:2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷
2014·全国·一模
6 . 下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
| A.HCl | B.HNO3 | C.CH3COOH | D.KOH |
您最近一年使用:0次
2013·上海闵行·三模
7 . 钠及其化合物在生产和生活中有广泛的应用。例如:Na2O2在医院、潜水、高空飞行中用作供氧剂。
(1)制备Na2O2的反应为:4Na+O2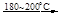 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。
①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为_________ 。
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为______________ 。
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有__________________________________ 。
②若2a=c,则M气体可能是什么气体?通过计算回答______ 。
(1)制备Na2O2的反应为:4Na+O2
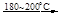 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。①实验测得某过氧化钠样品含有少量氧化钠杂质,其中钠、氧原子个数比为10︰9.5,该样品中Na2O2的纯度为
②取上述过氧化钠样品7.64g放入烧杯中,加入足量水,搅拌,使固体完全溶解,冷却后,在容量瓶中配制成100mL溶液,则该溶液中OH-离子的物质的量浓度为
(2)某同学为了检验引起光化学烟雾的气体成分(NO、CO、NO2、HCHO、CH3OH、CH4等),查阅资料得知:Na2O2+2NO→2NaNO2、Na2O2+2NO2→2NaNO3,于是取用a gM气体与b g 氧气混合后,用电火花不断引燃,充分反应后,气体通过足量Na2O2,Na2O2固体质量增加c g。
①若a=c,则M气体的成分可能含有
②若2a=c,则M气体可能是什么气体?通过计算回答
您最近一年使用:0次
13-14高三上·上海虹口·期末
解题方法
8 . 铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________ g。
②生成的CO2在标准状况下体积为________ mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度_______________ 。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量_____________ 。
②原带锈铁片中铁锈的质量分数_______________ 。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式________________ 。
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁
②生成的CO2在标准状况下体积为
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量
②原带锈铁片中铁锈的质量分数
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式
您最近一年使用:0次
10-11高一上·浙江宁波·期中
9 . 将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A. | B. | C.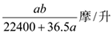 | D. |
您最近一年使用:0次
11-12高三上·江苏泰州·期中
解题方法
10 . 常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数。单位g/L)如下:
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
| 海水密度 (g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.04 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
| A.各种盐的溶解度增大 | B.海水中水的质量分数减小 |
| C.析出的粗盐中 NaCl的质量分数增大 | D.海水中Br-浓度不变 |
您最近一年使用:0次



